
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
科目:高中化学 来源: 题型:
【题目】常用药——羟苯水杨胺,其合成路线如下。回答下列问题:

已知:
(1)羟苯水杨胺的化学式为________。对于羟苯水杨胺,下列说法正确的是_______。
A.1mol羟苯水杨胺最多可以和2 molNaOH反应
B.不能发生硝化反应
C.可发生水解反应
D.可与溴发生取代反应
(2)D的名称为___________。
(3)A→B所需试剂为___________;A→B反应的有机反应类型是___________。
(4)B→C反应的化学方程式为_____________________。
(5)F存在多种同分异构体。
①F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是___________。
A.质谱仪 B.红外光谱仪 C.元素分析仪 D.核磁共振仪
②F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应的物质共有______种;写出其中核磁共振氢谱显示4组峰,且峰面积之比为1:2:2:1的同分异构体的结构简式_______。(写出一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类的生活、生产息息相关,下列说法正确的是
A.氯水和食盐水消毒杀菌的原理相同
B.制造普通玻璃的原料为石英砂、石灰石和纯碱
C.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
D.可以用钢瓶储存液氯和浓H2SO4,因为它们对钢瓶发生了钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯![]() 可用于制作食品包装袋,在一定条件下可通过乙烯生成聚乙烯,下列说法中正确的是( )
可用于制作食品包装袋,在一定条件下可通过乙烯生成聚乙烯,下列说法中正确的是( )
A. 燃烧等质量的乙烯和聚乙烯时,聚乙烯消耗的氧气多
B. 乙烯比乙烷的含碳量高,燃烧时容易产生浓烟
C. 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
D. 乙烯和聚乙烯都能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烷烃是指共用两个或两个以上碳原子的多环烷烃,二环[1,1,0] 是最简单的一种,结构简式如图。下列关于该化合物的说法错误的是
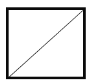
A.与1,3-丁二烯互为同分异构
B.一氯代物有2种,二氯代物共有4种(不考虑立体异构)
C.碳碳原子之间的夹角有45°和90°两种
D.与H2发生加成反应,生成1molC4H10理论上需要2molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2又称百毒净,可用于水的净化和纸浆、纺织品的漂白。用如下图所示装置(夹持装置和加热装置省略)制备ClO2并探究ClO2的某些性质。
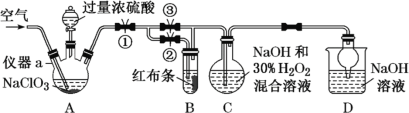
已知:①高氯酸:沸点90 ℃,浓度低于60%比较稳定,浓度高于60%遇含碳化合物易爆炸。
②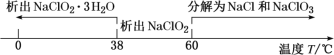
回答下列问题:
(1)仪器a的名称为_______。实验开始前,胶塞及导管接口必须包锡箔纸,其原因是__________。
(2)写出装置A制备ClO2同时生成高氯酸的化学方程式:___________。
(3)关闭止水夹②,打开止水夹①③,通空气一段时间,装置C中生成NaClO2,离子方程式为______。若关闭止水夹③,打开止水夹②,B中可观察到的现象为_______。
(4)从装置C反应后的溶液中获得NaClO2晶体,常采用减压蒸发结晶。采用减压蒸发的原因是______,减压蒸发时,当有较多晶体析出时,再_____(填操作方法),洗涤,干燥。即可得NaClO2。
(5)城市饮用水处理新技术用NaClO2、高铁酸钠替代Cl2。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,NaClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是________。
(6)ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样量取V0mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用cmol·L1Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1mL。
已知:2ClO2+10I+8H+=2Cl+5I2+4H2O,2Na2S2O3+I2=Na2S4O6+2NaI,计算该ClO2的浓度为________g/L(用含字母的代数式表示,计算结果化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际贸易可以互通有无,符合国际社会的根本利益,下列贸易商品中,主要成分属于无机物的是
A.巴西铁矿砂 | B.沙特石油 | C.俄罗斯天然气 | D.中国丝绸 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu发生的氧化还原反应,实验记录如下表所示,下列说法错误的是( )
序号 | Ⅰ | Ⅱ | Ⅲ |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜有剩余,溶液黄色褪去,变成蓝色加入蒸馏水后无白色沉淀 |
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及Fe3+被还原
B.对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液中阴离子种类有关
C.实验Ⅱ、Ⅲ中加水后c(Cu2+)相同
D.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种锂离子电池的反应式为 LixC6 + Li1xCoO2![]() 6C+LiCoO2(x<1)。其工作原理如图所示。下列说法不正确的是
6C+LiCoO2(x<1)。其工作原理如图所示。下列说法不正确的是
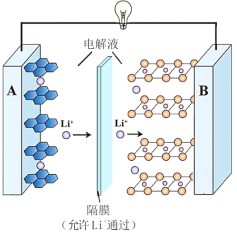
A.放电时,A 极电极式为:LixC6 xe = 6C + xLi+
B.放电时,若转移 0.3 mol 电子,石墨电极将减重 2.1g
C.充电时,Li+从左向右移动
D.若要从废旧该型锂电池的正极材料中回收锂元素,先进行放电处理,有利于 Li+尽可能从负极脱出,在正极富集
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com