
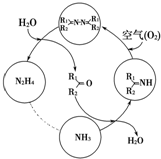
 利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).
利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).分析 ①由图示可知化合价不变的一种元素是+1价的氢;
②反应中当有1mol NH3转化为N2H4时,失去1mol的电子,而1mol氧气得到4mol的电子,根据得失电子守恒分析解答;
③可以通过增加通入氧气的量,来提高氨气的转化率,由此分析解答.
解答 解:①由图示可知化合价不变的一种元素是+1价的氢,故答案为:氢或H;
②反应中当有1mol NH3转化为N2H4时,失去1mol的电子,而1mol氧气得到4mol的电子,根据得失电子守恒可知消耗氧气的物质的量为=$\frac{1}{4}mol$=0.25 mol,
故答案为:0.25 mol;
③欲使生成的N2H4中不含NH3,可采取的措施增大混合气体中氧气的含量,使氨气完全转化,故答案为:增大混合气体中氧气的含量.
点评 本题考查氧化还原反应的知识,应用得失电子守恒和平衡的移动原理,和得失电子守恒的相关知识,比较容易.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
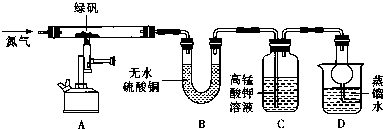
| 装置 | 现象 | 结论 |
| A | 固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液 | |
| B | 无水硫酸铜变蓝 | |
| C | 高锰酸钾溶液褪色 |
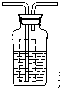 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | NH3$\stackrel{O_{2}/催化剂}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入 | 实验Ⅰ | 1.5mL 1mol•L-1 CuSO4溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ | 1.5mL 1mol•L-1 CuCl2溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
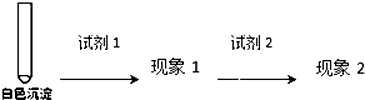
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中滴加NH4HSO4溶液至Ba2+沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将过量SO2气体通入氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| C. | 用醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片与浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向漂白精溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | H2C2O4溶液能使KMnO4酸性溶液褪色 2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| D. | 向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com