
【题目】常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是( )
A. CH4 B. C2H5OH C. C2H4O D. C3H8
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】下列各组微粒半径大小比较中,不正确的是( )
A. r(K)>r(Na)>r(Li) B. r(Mg2+)>r(Na+)>r(F-)
C. r( Na+)>r(Mg2+)>r(Al3+) D. r(Cl-)>r(F-)>r(F)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是( )
①pH=0的溶液:Na+、Cl-、MnO![]() 、SO
、SO![]()
②pH=11的溶液中:CO![]() 、Na+、AlO
、Na+、AlO![]() 、NO
、NO![]() 、S2-、SO
、S2-、SO![]()
③水电离的H+浓度c(H+)=10-12 mol·L-1的溶液中:Cl-、CO![]() 、NO
、NO![]() 、NH
、NH![]() 、SO
、SO![]()
④加入Mg能放出H2的溶液中:Mg2+、NH![]() 、Cl-、K+、SO
、Cl-、K+、SO![]()
⑤使石蕊变红的溶液中:Fe2+、MnO![]() 、NO
、NO![]() 、Na+、SO
、Na+、SO![]()
⑥中性溶液中:Fe3+、Al3+、NO![]() 、I-、Cl-、S2-
、I-、Cl-、S2-
A. ②④ B. ①③⑥
C. ①②⑤ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有K+、NH4+、Mg2+、Fe2+、Fe3+、SO42-、Br-、Cl-、CO32-中的若干种,离子浓度均相等,实验及现象如下:
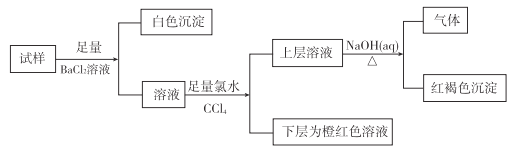
下列判断正确的是
A. 白色沉淀是BaSO4和BaCO3
B. 原溶液存在Fe3+,不存在Fe2+
C. 若原溶液存在Fe3+,必然存在Cl-,无K+
D. 原溶液不存在CO32-、Mg2+、K+、C1-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一医药中间体的结构简式如下: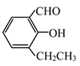
(1)其分子式为______ ,含有的含碳官能团名称为______.
(2)关于其化学性质的描述,下列不正确的是(_____).
A. 能与氯化铁溶液发生化学反应 B. 能发生银镜反应
C. 能使溴水褪色 D. 能发生消去反应
(3)一定条件下,1mol该物质最多可与____ molH2发生加成反应.
(4)同时符合下列条件的同分异构体有____ 种.
①苯环上只有两个取代基; ②能与碳酸氢钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Sn元素位于元素周期表第IVA族,SnCl4可用作媒染剂和催化剂,工业上常用氯气与金属锡在300℃反应制备SnCl4。SnCl4极易水解,SnCl2、SnCl4的一些物理数据如下:
物质 | 状态 | 熔点/X; | 沸点/X; |
Sn | 银白色固体 | 232 | 2 260 |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
用下列装置合成四氯化锡(夹持装置略)。
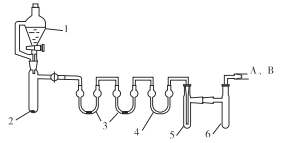
注:仪器3中各加入0.6 mL浓硫酸
实验操作如下:
a.把干燥的仪器按图示装置连接好,在仪器1中加入8 mL浓盐酸,在仪器2中加入1.0 g KClO3,在仪器5中加入2~3颗Sn粒;
b.打开活塞,让盐酸流下,均匀产生Cl2并充满整套装置,然后加热Sn粒,将生成的SnCl4收集在仪器 6中;
c.Sn粒反应完毕后,停止加热,同时停止滴加盐酸,取下仪器6,迅速盖好盖子。
请回答:
(1)仪器1的名称是___________。
(2)下列说法不正确的是______。
A.装置连接好,加入药品前要检査装置的气密性
B.产生的Cl2先充满整套装置,这步操作不可以省略
C.操作中应控制盐酸的滴入速率,不能太快,也不能太慢
D.仪器6可用冰水浴冷却,也可以自然冷却
(3)仪器6后还应连接A、B装置,A装置的作用是_____________。
(4)已知SnCl2易水解,易氧化,且还原性:Sn2+>I-,SnCl4氧化性弱。有关SnCl4和SnCl2的说法不正确的是_________。
A.实验室配制SnCl2溶液时,除加入盐酸外,还应加入锡粒
B.将产品溶于盐酸,可用溴水检测,若溴水橙色褪去,说明SnCl4中含有SnCl2
C. SnCl4在空气中与水蒸气反应生成白色SnO2·xH2O固体,只看到有白烟现象,化学方程式为SnCl4+(x+2)H2O=SnO2·xH2O+4HC1
(5)经测定产品中含冇少量的SnCl2,可能的原因(用化学方程式表示):_______________。
(6)产品中含少量SnCl2,测定SnCl4纯度的方法:取0.200 g产品溶于50 mL的稀盐酸中,加入淀粉溶液 作指示剂,用0.0100mol/L碘酸钾标准溶液滴定至终点,消耗标准液4.00 mL,反应原理为:3 SnCl2+KIO3+6HC1=3SnCl4+KI+3H2O,判断滴定终点的依据为_______,产品的纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、 NH4+、 Mg2+、 Ba2+、 Cl-、 SO42—、 CO32—。
将该混合物溶于水后得澄清溶液。 现取3份100 mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
A | 加 AgNO3溶液 | 有白色沉淀生成 |
B | 加足量 NaOH 溶液并加热 | 收集到气体 1.12 L(标准状况下) |
C | 加足量 BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥称量 | 第一次称量沉淀质量为6.63 g,第二次称量沉淀质量为4.66 g |
试回答下列问题:
(1)根据实验A判断 Cl-是否存在_____(填“一定存在” 、 “一定不存在” 或“不能确定”)。
(2)该混合物中一定不存在的离子是_____。
(3)写出实验B发生反应的离子方程式_____________。
(4)溶液中一定存在的阴离子及其物质的量浓度为(可不填满):
阴离子符号 | 物质的量浓度(mol·L-1) |
(5)混合物中是否存在 K+?_____(填“存在” 或“不存在” )
①如果存在, c(K+) _____mol/L(如果选择“不存在” ,此问不必做答)
②如果不存在,判断的理由是_____。(如果选择“存在” ,此问不必做答)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com