
| A. | 金属元素在不同化合物中化合价均不同 | |
| B. | 钾的金属性强,所以钾与水的反应比钠的反应剧烈 | |
| C. | 食物放在冰箱中会减慢食物变质的速率 | |
| D. | 面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸 |
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯在催化剂作用下能与溴水发生取代反应 | |
| B. | 实验室用CaC2和饱和食盐水制备乙炔 | |
| C. | 氯乙烷在氢氧化钠的水溶液中生成乙烯 | |
| D. | 将苯、浓HNO3的混合物用水浴加热(60℃左右)制备硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图,A池用石墨电极电解饱和KCl溶液,B池精炼粗铜,当d极产生具有氧化性的气体在标准状况下为2.24L时停止通电,此时A池中KCl有剩余且溶液的体积为200mL,下列说法正确的是( )
如图,A池用石墨电极电解饱和KCl溶液,B池精炼粗铜,当d极产生具有氧化性的气体在标准状况下为2.24L时停止通电,此时A池中KCl有剩余且溶液的体积为200mL,下列说法正确的是( )| A. | 向A池中通入4.48 L HCl气体可恢复到电解前的状态 | |
| B. | 停止通电后恢复至室温A池中溶液的pH值为14 | |
| C. | 电极e应为粗铜板材料且质量减少6.4 g | |
| D. | 该电路中通过的电子的物质的量为0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
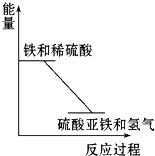 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +2Ag[(NH3)2]OH
+2Ag[(NH3)2]OH
 +2Ag+3NH3+H2O
+2Ag+3NH3+H2O ,通过类似反应柠檬烯可由一种有机物合成得到,该有机物的结构简式为
,通过类似反应柠檬烯可由一种有机物合成得到,该有机物的结构简式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 | |
| B. | 除去甲烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 | |
| C. | 苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环 | |
| D. | 乙酸和乙醇在浓硫酸作用下可以反应,该反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com