
| A. | Zn | B. | Fe | C. | Al | D. | Mg |
分析 标况下2.24L氢气的物质的量为0.1mol,故6g金属提供的电子为0.1mol×2=0.2mol,故提供1mol电子需要金属质量为30g,结合化合价计算提供1mol电子需要各金属的质量,混合各组分的质量满足都等于30g或满足有的组分小于30g、有的组分大于30g,注意若金属不与酸反应生成氢气,视作提供1mol电子需要金属质量为无穷大.
解答 解:标况下2.24L氢气的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,故6g金属提供的电子为0.1mol×2=0.2mol,故提供1mol电子需要金属质量为6g×$\frac{1mol}{0.2mol}$=30g.
A.Zn在反应中表现+2价,提供1mol电子需要Zn的质量为65g/mol×$\frac{1mol}{2}$=32.5g,
B.Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol×$\frac{1mol}{2}$=28g,
C.Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×$\frac{1mol}{3}$=9g,
D.Mg在反应中表现+2价,提供1mol电子需要Mg的质量为24g/mol×$\frac{1mol}{2}$=12g,
提供1mol电子,只有Zn的质量大于30g,其它金属的质量都小于30g,故金属混合物中一定有Zn,
故选:A.
点评 本题考查混合物的计算,题目难度中等,侧重对学生思维能力的考查,注意利用平均值法解答,注意若有不反应的金属应视作需金属质量无穷大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁做还原剂 | B. | Fe2O3做氧化剂 | ||
| C. | 铁元素被还原 | D. | 铁元素化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
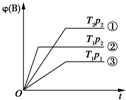 已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )| A. | T1<T2,p1>p2,m+n>p,放热反应 | B. | T1>T2,p1<p2,m+n>p,吸热反应 | ||
| C. | T1<T2,p1>p2,m+n<p,放热反应 | D. | T1>T2,p1<p2,m+n<p,吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH Na2SO4 HCl | B. | NaHCO3 NaNO3 H2SO4 | ||
| C. | HCl Na2CO3 NaCl | D. | Ca(OH)2 Na2CO3 BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
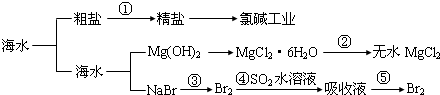
| A. | 第①步中除去泥沙及Ca2+、Mg2+等杂质时,不涉及化学变化过程 | |
| B. | 工业上,通过电解“精盐”水溶液可以制取金属钠 | |
| C. | 第②步的反应条件是“在空气中直接加热” | |
| D. | 第③、④、⑤步中均涉及氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com