
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 一定温度下,1 L 0.50 mol•L-1 NH4NO3溶液中含氮原子个数为NA | |
| C. | 过氧化氢分解制得1.12 L O2,转移电子数目为 0.2 NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$Xe+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA |
分析 A、NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2?N2O4;
B、求出硝酸铵的物质的量,然后根据1mol硝酸铵中含2molN原子来分析;
C、氧气的状态不明确;
D、92235U+01n$\stackrel{裂变}{→}$3890Sr+54136U+1001n净产生的中子为10-1=9个.
解答 解:A、NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2?N2O4,所以产物分子数小于2NA,故A错误;
B、溶液中硝酸铵的物质的量n=CV=0.5mol/L×1L=0.5mol,而1mol硝酸铵中含2molN原子,故0.5mol硝酸铵中含1mol氮原子即NA个,故B正确;
C、氧气的状态不明确,故1.12L氧气的物质的量无法计算,故C错误;
D、92235U+01n$\stackrel{裂变}{→}$3890Sr+54136U+1001n净产生的中子为10-1=9个,则235g核素92235U发生裂变反应净产生的中子(01n)数为9NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L | B. | 0.5L | C. | 0.3L | D. | 0.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
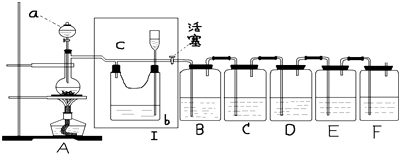
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
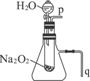 教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.
教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
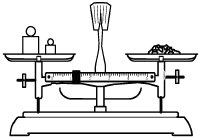 |  | 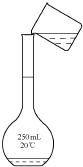 | 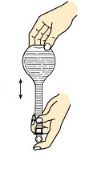 |
| A.称量 | B.溶解 | C.转移 | D.摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
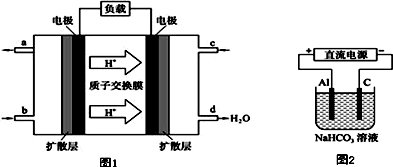
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
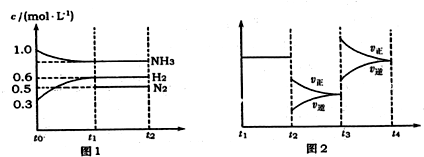
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管内气体呈红棕色 | B. | 试管内气体无色,是NO | ||
| C. | 试管内气体无色,是O2 | D. | 试管内液面下降 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com