
| A. | 食盐溶于水 | B. | 碳酸氢钠溶于水 | C. | 将HCl通入水中 | D. | 氯化铵受热分解 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间存在离子键,据此分析解答.
解答 解:A.氯化钠中只含离子键,氯化钠溶于水电离生成钠离子和氯离子,只破坏离子键,故A错误;
B.碳酸氢钠溶于水时电离生成钠离子和碳酸氢根离子,钠离子和碳酸氢根离子之间存在离子键,所以只破坏离子键,故B错误;
C.HCl中只含共价键,溶于水发生电离时只破坏共价键,故C错误;
D.氯化铵中铵根离子和氯离子之间存在离子键、铵根离子中N-H原子之间存在共价键,氯化铵分解生成氨气和HCl,破坏离子键和共价键,故D正确;
故选D.
点评 本题考查化学键,为高频考点,明确离子键和共价键区别是解本题关键,侧重考查学生分析判断能力,题目难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入BaCl2溶液,产生了白色沉淀,再加入足量的HCl溶液,沉淀不溶解,溶液中一定含有大量SO${\;}_{4}^{2-}$ | |
| B. | 加入足量的CaCl2溶液,产生了白色沉淀,加入盐酸可以产生无色且能使澄清石灰水变浑浊的气体,则该溶液不一定含有大量的CO${\;}_{3}^{2-}$ | |
| C. | 加入足量浓 NaOH溶液加热,产生了带有强烈刺激性气味的能使湿润的红色石蕊试纸变蓝的气体,溶液中一定含有大量的NH${\;}_{4}^{+}$ | |
| D. | 先加适量的硝酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.溶液中一定含有大量的Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1 | B. | 1.5 mol•L-1 | C. | 2 mol•L-1 | D. | 2.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1mol•L-1HF 溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 加入CaCl2溶液后体系中的c(H+)不变 | |
| D. | 该体系中HF与CaCl2反应产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
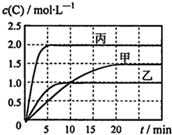 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T3 |
| 反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 达平衡时A(g)的浓度:乙=丙>甲 | |
| B. | 甲容器中达平衡时B(g)的转化率为75% | |
| C. | 温度分别为T1、T2时,该反应的平衡常数:K(T1)<K(T2) | |
| D. | 丙容器中达到平衡后,若同时向容器中再充入1mol A(g)、1mol B(g)、1molC(g),则平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com