
【题目】红色固体X由两种元素组成,为探究其组成和性质,设计了如下实验:

请回答:
(1)气体Y的一种同素异形体的分子式是______,红褐色沉淀的化学式______。
(2)X在隔绝空气条件下受高温分解为Y和Z的化学方程式____________。
(3)取黄色溶液W滴加在淀粉KI试纸上,试纸变蓝色,用离子方程式表示试纸变蓝的原因____________。
【答案】O3 Fe(OH)3 6Fe2O3![]() 4Fe3O4+O2↑ 2I-+2Fe3+=2Fe2++I2
4Fe3O4+O2↑ 2I-+2Fe3+=2Fe2++I2
【解析】
无色气体Y为O2,同素异形体的分子式是O3,且X中含有铁元素,结合“红褐色”沉淀灼烧后能得到X,可以推断得到X为氧化铁,再根据X分解得到Y与Z的量的关系可知,Z为Fe3O4,W为FeCl3,红褐色沉淀为Fe(OH)3。由于FeCl3具有较强的氧化性,所以将FeCl3溶液滴加在淀粉KI试纸上时会有I2生成,而使试纸变蓝色,据此分析解答。
无色气体Y为O2,同素异形体的分子式是O3,且X中含有铁元素,结合“红褐色”沉淀灼烧后能得到X,可以推断得到X为氧化铁,再根据X分解得到Y与Z的量的关系可知,Z为Fe3O4,W为FeCl3,红褐色沉淀为Fe(OH)3;由于FeCl3具有较强的氧化性,所以将FeCl3溶液滴加在淀粉KI试纸上时会有I2生成,而使试纸变蓝色,
(1)无色气体Y为O2,其同素异形体的分子式是O3;红褐色沉淀为Fe(OH)3;
故答案为:O3;Fe(OH)3;
(2)X为Fe2O3,Y为O2,Z为Fe3O4,Fe2O3在隔绝空气条件下受热高温分解为Fe3O4和O2,化学反应方程式为6Fe2O3![]() 4Fe3O4+O2↑;
4Fe3O4+O2↑;
故答案为:6Fe2O3![]() 4Fe3O4+O2↑;
4Fe3O4+O2↑;
(3)W为FeCl3,FeCl3具有较强的氧化性,能将KI氧化为I2,试纸变蓝色,反应的离子方程式为2I-+2Fe3+=2Fe2++I2;
故答案为:2I-+2Fe3+=2Fe2++I2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知AgI为黄色沉淀,AgCl为白色沉淀。25°C时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5mL含有KCl和KI浓度均为0.01mol·L-1的混合溶液中,滴加8mL0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是
A. 溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3—)>c(Cl-)>c(I-)>c(Ag+)
B. 溶液中先产生的是AgI沉淀
C. AgCl的Ksp的数值为1.69×10-10
D. 若在AgI悬浊液中滴加少量的KCl稀溶液,黄色沉淀不会转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为没食子酸(记做W),在一定条件下W可分别转化为X、Y,下列说法正确的是( )
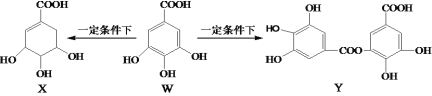
A.X和W都能与溴水发生加成反应
B.X能发生加成、消去、缩聚等反应
C.1molY最多能与7molNaOH发生反应
D.1molY水解生成两种有机化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置:

(1)A是氯气发生装置,其中反应的化学方程式为_____。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:_____。装置C的作用是_____。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是_____。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程现象为_____(选填标号)。
A.有白色沉淀生成 B.无现象 C.先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是_____,B的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。下列说法正确的是( )
标注。下列说法正确的是( )

A.水煤气变换反应的ΔH>0
B.步骤③的化学方程式为:CO●+OH●+H2O(g)=COOH●+H2O●
C.步骤⑤只有非极性键H-H键形成
D.该历程中最大能垒(活化能)E正=1.70eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的a、b、c、d四种主族元素,其中a和d同族,a-的电子层结构与氦相同,b和c的次外层有8个电子,b2-、c-和d+的电子层结构相同。下列错误的是( )
A.元素的非金属性次序为c>b>a
B.b2-的还原性弱于c-的还原性
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质属于同分异构体是___;属于同素异形体是___;属于同位素是___;属于同一种物质是___。(写序号)
①红磷与白磷 ②12C与14C ③干冰与二氧化碳 ④CH4与CH3CH3 ⑤S2与S8 ⑥235U与238U ⑦![]() 与
与![]() ⑧乙醇(
⑧乙醇( )与二甲醚(
)与二甲醚( ) ⑨
) ⑨ 和
和![]() ⑩氰酸铵(NH4CNO)与尿素[CO(NH2)2]
⑩氰酸铵(NH4CNO)与尿素[CO(NH2)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用广泛pH试纸测得氯水的pH为2.1
B.用玻璃棒蘸取溶液滴在已润湿的pH试纸上测得其pH为12
C.常温下0.1 mol/L的CH3COOH溶液加水稀释,![]() 比值变大
比值变大
D.常温下某溶液中由水电离出的c(H+)为1.0×10-12mol·L-1,一定是碱性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、铬在元素周期表均为过渡金属元素,其中基态铬原子的价电子排布式为______。
(2)Na、O、S简单离子半径由大到小的顺序为___________(用简单离子符号表示离子半径)。
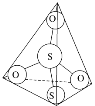
(3)S2O32-离子结构如图1所示,其中心硫原子的杂化轨道类型为________。
(4)Na3[Ag(S2O3)2]中存在的作用力有_____________。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子空间构型为____________________;与SO3相比,____________的键角更大,原因是________________________________。
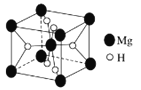
(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为____________________,已知该晶体的密度为ρg/cm3,则该晶胞的体积为_________ cm3(用含ρ、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com