
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(B)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 反应前2min的平均速率v(B)=0.15 mol/(L•min) | |
| B. | 保持其他条件不变,升高温度,平衡时c(B)=0.22 mol•L-1,则反应的△H<0 | |
| C. | 保持其他条件不变,起始向容器中充入2.0 mol A,反应达到平衡时C的体积分数减小 | |
| D. | 保持其他条件不变,增大该反应体系的压强,平衡左移,反应的平衡常数K减小 |
分析 A.根据V=$\frac{△c}{△t}$进行计算;
B.由表中数据可知,6s、8s时B的物质的量都是0.4mol,说明6s时反应到达平衡,平衡时B的浓度为0.2mol.L,升高温度,到达新平衡,B的浓度变为0.22mol/L,B浓度增大,说明平衡向生成B的方向移动;
C.向容器中充入2.0 mol A,相当于在上述平衡的基础上加压,平衡在原来的基础上向逆反应方向移动;
D.平衡常数仅与温度有关.
解答 解:A.根据V=$\frac{△c}{△t}$=$\frac{\frac{0.30-0}{2}}{2}$=0.075 mol/(L•S),故A错误;
B.由表中数据可知,6s、8s时B的物质的量都是0.4mol,说明6s时反应到达平衡,平衡时B的浓度为0.2mol/L,升高温度,到达新平衡,B的浓度变为0.22mol/L,B浓度增大,说明平衡向正反应方向移动,故正反应为吸热反应,即△H>0,故B错误;
C.向容器中充入2.0 mol A,相当于在上述平衡的基础上加压,平衡在原来的基础上向逆反应方向移动,所以平衡时C的体积分数减小,故C正确;
D.平衡常数仅与温度有关,所以保持其他条件不变,增大该反应体系的压强,平衡左移,反应的平衡常数K不变,故D错误;
故选:C.
点评 本题综合考查化学平衡的计算、等效平衡,难度较大,注意理解平衡常数的意义及应用,注意D选项中平衡常数仅与温度有关.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
 的名称2,3-二甲基戊烷
的名称2,3-二甲基戊烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4 L氨水含有NA个NH3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 少量SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| D. | 相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸馏 | |
| B. | 利用银镜反应进行分离 | |
| C. | 加入Na2CO3后,通过萃取的方法分离 | |
| D. | 先加入烧碱溶液,之后蒸馏出乙醛;再加入浓硫酸,蒸馏出乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白磷在冷水中,通入空气也能燃烧 | |
| B. | 酒精灯里的酒精不慎溢出着火,迅速用湿抹布盖灭 | |
| C. | 不能用燃着的木条鉴别氧气、空气和二氧化碳 | |
| D. | 用金刚石去冰箱里的异味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
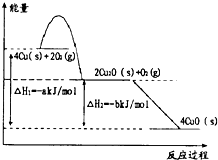 铜及其化合物在工业、农业、科技和日常生活中有广泛应用.
铜及其化合物在工业、农业、科技和日常生活中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向pH=13的NaOH溶液中不断加水稀释 | |
| B. |  向碳酸氢钠溶液中逐滴加入稀盐酸至过量 | |
| C. |  将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 | |
| D. |  将足量的金属镁片和锌片分别和等质量、相同质量分数的稀硫酸混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
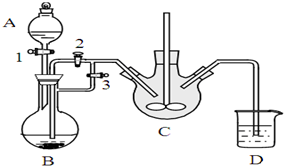 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com