
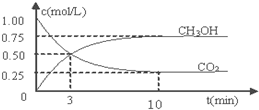
分析 ①由图可知,生成甲醇为0.75mol,则参加反应的氢气为0.75mol×3=2.25mol,结合转化率=$\frac{反应的量}{开始的量}$×100%;
②反应进行到3min时,甲醇的物质的量在增加,10min达到平衡;
③K为生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算.
解答 解:①由图可知,生成甲醇为0.75mol,则参加反应的氢气为0.75mol×3=2.25mol,氢气的转化率=$\frac{反应的量}{开始的量}$×100%=$\frac{2.25mol}{3mol}$×100%=75%,
故答案为:75%;
②反应进行到3min时,甲醇的物质的量在增加,10min达到平衡,可知3min时,向正反应方向移动,则v正>v逆,故答案为:>;
③K为生成物浓度幂之积与反应物浓度幂之积的比,则K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始 1 3 0 0
转化 0.75 2.25 0.75 0.75
平衡 0.25 0.75 0.75 0.75
体积为1L的密闭容器,平衡浓度分别为0.25mol/L、0.75mol/L、0.75mol/L、0.75mol/L,
K=$\frac{0.75×0.75}{0.25×(0.75)^{3}}$=$\frac{16}{3}$,
故答案为:K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;$\frac{16}{3}$.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率计算等为解答的关键,侧重分析与计算能力的考查,注意K的计算利用平衡浓度,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①④⑥ | C. | ②③⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B的转化率均是20% | B. | x=4 | ||
| C. | 平衡时A的物质的量为3.2mol | D. | 平衡时气体压强比原来减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.回答有关中和反应的问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m值为3 | |
| B. | B的转化率为20% | |
| C. | A的平均反应速率为0.1mol•L-1•min-1 | |
| D. | 平衡时反应混合物总物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱式滴定管用蒸馏水洗净后,直接注入标准浓度的NaOH溶液 | |
| B. | 碱式滴定管尖端有气泡,滴定后气泡消失 | |
| C. | 记录消耗的碱液,滴定前平视,滴定后俯视凹液面 | |
| D. | 锥形瓶用蒸馏水洗净后,直接装入未知浓度的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(l);|△H|>297.3kJ/mol | |
| B. | S(g)+O2(g)=SO2(l);|△H|<297.3kJ/mol | |
| C. | 1mol SO2的键能总和小于1mol S和1mol O2键能之和 | |
| D. | 1mol SO2的具有的能量等于1mol S和1mol O2具有的能量之和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com