
将11.9 g Mg、Al、Fe组成的合金溶于足量NaOH溶液中,产生的气体在标准状况下的体积为3.36 L。另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的溶液中加入过量NaOH溶液,得到沉淀19.4 g,则上述反应中生成NO气体的体积为(标准状况下) ( )。
A.6.72 L B.11.2 L
C.22.4 L D.4.48 L
解析 本题考查金属与酸、碱反应的计算,意在考查考生对金属的性质的理解能力。合金溶于足量NaOH溶液中,只有Al发生反应,根据2Al~3H2,n(Al)=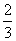 n(H2)=
n(H2)=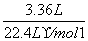 ×
×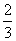 =0.1 mol;合金溶于过量稀硝酸后,加入过量NaOH溶液,最终得到的沉淀为Mg(OH)2、Fe(OH)3,设合金中Mg、Fe的物质的量分别为x mol、y mol,则24x+56y=11.9-27×0.1、58x+107y=19.4,联立两式解得x=0.15,y=0.1。该合金与稀硝酸反应时,根据得失电子守恒,有3n(Al)+2n(Mg)+3n(Fe)=3n(NO),则n(NO)=
=0.1 mol;合金溶于过量稀硝酸后,加入过量NaOH溶液,最终得到的沉淀为Mg(OH)2、Fe(OH)3,设合金中Mg、Fe的物质的量分别为x mol、y mol,则24x+56y=11.9-27×0.1、58x+107y=19.4,联立两式解得x=0.15,y=0.1。该合金与稀硝酸反应时,根据得失电子守恒,有3n(Al)+2n(Mg)+3n(Fe)=3n(NO),则n(NO)=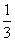 ×(0.1×3+0.15×2+0.1×3) mol=0.3 mol,V(NO)=22.4 L·mol-1×0.3 mol=6.72 L,A项正确。
×(0.1×3+0.15×2+0.1×3) mol=0.3 mol,V(NO)=22.4 L·mol-1×0.3 mol=6.72 L,A项正确。
答案 A


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
下列说法错误的是( )
A.鸡蛋清和淀粉可以用浓硝酸鉴别
B.用甘氨酸和丙氨酸缩合最多可形成4种二肽
C.分子式为C5H8O2,既与碳酸钠溶液反应又与溴的四氯化碳溶液反应的有机物有8种
D.乳酸薄荷醇酯(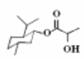 )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体物质是 ( )。
A.Na2SiO3 B.Na2CO3、Na2SiO3
C.Na2CO3、SiO2 D.SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示。则原H2SO4物质的量浓度是 ( )。
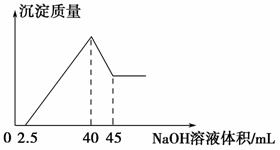
A.1 mol·L-1 B.2 mol·L-1
C.3 mol·L-1 D.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | CO |
| 阳离子 | Al3+、Fe3+、Mg2+、NH |

现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则Oa段转化为沉淀的离子(指来源于X溶液的,下同)是_______________________________________________________________,
ab段发生反应的离子是________,bc段发生反应的离子方程式为________________________________________________________________。
(2)若Y是NaOH溶液,则X中一定含有的离子是________,ab段反应的离子方程式为_______________________________________________________
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法正确的是 ( )。

A.相对于途径②,途径①更好地体现了绿色化学思想
B.Y可以是葡萄糖溶液
C.X可能是SO2和SO3的混合气体
D.将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________;Y与过量浓硝酸反应后溶液中含有的盐的化学式为______________________________________________________________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________。
A.Mg2+ B.Fe2+
C.Al3+ D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
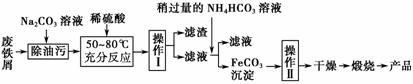
回答下列问题:
①操作Ⅰ的名称是________;操作Ⅱ的名称是________;操作Ⅱ的方法为______________________________________________________________。
②请写出生成FeCO3沉淀的离子方程式:_________________________ _______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年7月四川省部分地区遭遇强降雨天气,当地居民饮用水受到严重污染。高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:

(1)高铁酸钾中铁元素的化合价为________,推测它具有的化学性质是__________________。
(2)在NaClO溶液中加入烧碱固体形成碱性环境,将研磨的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h。发生的离子反应为2Fe3++3ClO-+10OH-===2FeO +3Cl-+5H2O,氧化剂是________。将KOH加入反应后的溶液中搅拌半小时,静置,过滤粗产品,该过程发生的反应为2KOH+Na2FeO4===K2FeO4+2NaOH,根据复分解反应原理,高铁酸钠的溶解度________(填“大于”、“小于”或“等于”)高铁酸钾的溶解度。
+3Cl-+5H2O,氧化剂是________。将KOH加入反应后的溶液中搅拌半小时,静置,过滤粗产品,该过程发生的反应为2KOH+Na2FeO4===K2FeO4+2NaOH,根据复分解反应原理,高铁酸钠的溶解度________(填“大于”、“小于”或“等于”)高铁酸钾的溶解度。
(3)在强碱性溶液中,高铁酸钾能将亚铬酸钾(KCrO2)氧化为铬酸钾(K2CrO4),生成的铬酸盐溶解酸化后,得到的重铬酸钾(K2Cr2O7)用(NH4)2Fe(SO4)2标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价铬),有关反应的离子方程式为FeO +CrO
+CrO +2H2O===CrO
+2H2O===CrO +Fe(OH)3↓+OH-,2CrO
+Fe(OH)3↓+OH-,2CrO +2H+===Cr2O
+2H+===Cr2O +H2O,Cr2O
+H2O,Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O。
+6Fe2++14H+===2Cr3++6Fe3++7H2O。
现称取5.00 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL 容量瓶中,定容,量取25.00 mL,再用稀硫酸酸化,用0.100 0 mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定,消耗标准溶液33.33 mL。计算上述实验制得的样品中高铁酸钾的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com