
(1)在反应2MnO4﹣+5H2S+6H+=2Mn2++5S↓+8H2O中,电子转移总数为10e﹣还原剂为H2S还原产物为 ,当反应中有80gS析出时,有 mol MnO4﹣被还原
(2)“绿色试剂”双氧水可作为采矿业废液消毒剂,如果要消除采矿业废液中的氰化物(如KCN),化学反应方程式为:KCN+H2O2+H2O=KHCO3+NH3↑.
①反应中发生氧化反应的物质为 ;
②H2O2被称为绿色氧化剂的理由是 .
③用单线桥表示出该反应电子转移的方向和数目:KCN+H2O2+H2O=KHCO3+NH3↑
考点: 氧化还原反应.
分析: (1)2MnO4﹣+5H2S+6H+═2Mn2++5S↓+8H2O中,Mn元素由+7价降低为+2价,该反应中转移2×(7﹣2)e﹣,S元素的化合价由﹣2价升高为0,含元素化合价升高的物质为还原剂,氧化剂对应的产物为还原产物;该反应中生成5molS时,2molMnO4﹣被还原,5molH2S被氧化,以此来解答;
(2)①根据化合价升高为还原剂发生氧化反应判断;
②根据产物的性质判断;
③根据氨气与转移电子的关系计算.
解答: 解:(1)2MnO4﹣+5H2S+6H+═2Mn2++5S↓+8H2O中,Mn元素由+7价降低为+2价,该反应中转移2×(7﹣2)e﹣,=10e﹣,
S元素的化合价由﹣2价升高为0,则H2S为还原剂,
MnO4﹣为氧化剂,对应的产物Mn2+为还原产物;
该反应中生成5molS时,2molMnO4﹣被还原,5molH2S被氧化,
80gS的物质的量为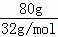 =2.5mol,
=2.5mol,
则有1molMnO4﹣被还原,2.5molH2S被氧化,2.5molH2S的质量为2.5mol×34g/mol=85g,
故答案为:10e﹣;H2S;Mn2+;1;还原;
(2)①KCN→KHCO3,C元素由+2价→+4价,KCN失电子作还原剂,发生氧化反应,故答案为;KCN;
②双氧水发生反应后生成水,对环境无污染,故答案为:反应后一般被还原为水,无污染;
③该反应中转移2个电子;
KCN+H2O2+H2O=KHCO3+NH3↑,所以单线桥表示出该反应电子转移的方向和数目为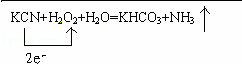 ,
,
故答案为: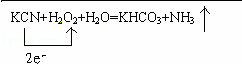 .
.
点评: 本题考查氧化还原反应的计算,明确氧化还原反应中的元素的化合价变化及氧化还原反应中的基本概念即可解答,注意物质的量与转移电子数的关系,题目难度不大.


科目:高中化学 来源: 题型:
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.由此判断,影响化学反应速率的因素有 和 .
(2)元素周期表共有7周期,16族;同一周期元素的原子 相同.
(3)在 H、
H、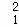 H、
H、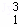 H、
H、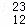 Mg、
Mg、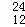 Mg和
Mg和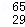 Cu中共有 种元素, 种原子.
Cu中共有 种元素, 种原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下发生如下反应:2KClO3+I2=2KIO3+Cl2,则下列推断正确的是()
A. 该反应属于置换反应
B. 该反应中氧化剂为I2
C. 该反应中还原剂为KClO3
D. 该反应中KClO3被还原为Cl2,I2被氧化为KIO3
查看答案和解析>>
科目:高中化学 来源: 题型:
把VL含有MgSO4和K2SO4的混合溶液分成两份,一份加入a mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含b mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁.则原混合溶液中钾离子的浓度为()mol/L.
A. 2b﹣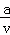 B. 2a﹣
B. 2a﹣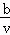 C.
C. 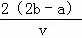 D.
D. 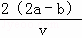
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1mol H2O2放出热量98kJ,在含少量I﹣的溶液中,H2O2分解的机理为:
H2O2+I﹣→H2O+IO﹣ 慢
H2O2+IO﹣→H2O+O2+I﹣ 快
下列有关该反应的说法正确的是()
A. 反应速率与I﹣的浓度有关 B. IO﹣也是该反应的催化剂
C. 反应活化能等于98kJ•mol﹣1 D. v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
电解100mL含c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是()
A. 0.10 mol/L Ag+ B. 0.20 mol/L Zn2+
C. 0.20 mol/L Cu2+ D. 0.20 mol/L Pb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
反应 A+B→C 的反应速率方程式为:v=k c(A)•c(B),v为反应速率,k为速率常数.当c(A)=c(B)=1mol/L时,反应速率在数值上等于速率常数.下列说法正确的是()
A. 只增大c(A)时,v也增大 B. 只增大c(A)时,v值不变
C. 只升高温度时,k值不变 D. 只升高温度时,k值变小
查看答案和解析>>
科目:高中化学 来源: 题型:
一定质量的液态化合物XY2,在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)═XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
(1)反应前O2的体积是 .
(2)化合物XY2的摩尔质量是 .
(3)若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为 和 (写元素符号).请写出 Y的离子结构示意图为 .
(4)已知X元素有aX、bX、cX三种原子,Y元素有eY、f Y 两种原子,则它们能够形成 种XY2分子.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com