
分析 ①取此溶液少许,滴在石蕊试纸上,试纸显红色,说明溶液呈酸性,则存在H+,肯定不能大量存在OH-、CO32-,则由溶液的电中性可知含有SO42-,不能存在Ba2+、Ag+;
②然后加入足量盐酸,观察不到明显现象,说明不含Ag+;
③另取少许此溶液,加入足量氢氧化钠溶液,有白色沉淀生成,说明含有Mg2+,以此解答该题.
解答 解:①取此溶液少许,滴在石蕊试纸上,试纸显红色,说明溶液呈酸性,则存在H+,肯定不能大量存在OH-、CO32-,则由溶液的电中性可知含有SO42-,不能存在Ba2+、Ag+;
②然后加入足量盐酸,观察不到明显现象,说明不含Ag+;
③另取少许此溶液,加入足量氢氧化钠溶液,有白色沉淀生成,说明含有Mg2+,
(1)根据以上分析可知,该溶液中一定存在的离子有:H+、Mg2+、SO42-;一定不存在的离子为:Ba2+、Ag+ OH-、CO32-,
故答案为:H+、Mg2+、SO42-; Ba2+、Ag+、OH-、CO32-;
(2)以上信息中存在的反应有:镁离子与氢氧根离子生成氢氧化镁沉淀,离子方程式为:Mg2++2 OH-=Mg(OH)2↓,故答案为:Mg2++2OH-=Mg(OH)2↓.
点评 本题考查了离子反应、常见的离子检验方法,为高频考点,题目难度中等,注意熟练掌握常见离子之间发生的反应现象及离子检验的方法,明确某些离子的特征反应,如铝离子、亚铁离子的特征反应.


科目:高中化学 来源: 题型:选择题
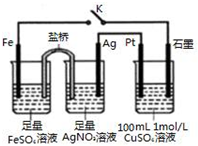
| A. | 盐桥中的电解质不可以用KCl | |
| B. | 导线中通过0.5 mol e-后,向CuSO4溶液中加入12.4g CuCO3,该溶液可恢复原组成 | |
| C. | 闭合K,Pt电极上发生的反应为:4OH--4e-=O2↑+2H2O | |
| D. | 闭合K,整个电路中电流的流向为:Ag电极→Pt电极→石墨电极→Fe电极→Ag电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯与等物质的量氯化氢加成只生成一种产物 | |
| B. | 1mol丙烯完全燃烧的耗氧量为4.5mol | |
| C. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| D. | 1mol丙烯和1mol聚丙烯完全燃烧放出CO2的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 P>S>Cl | |
| B. | 最高价氧化物对应水化物的酸性 H3PO4<H2SO4<HClO4 | |
| C. | 氢化物的稳定性 PH3<H2S<HCl | |
| D. | 元素的非金属性 P>S>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常采用电解法冶炼Y 单质 | |
| B. | 气态氢化物的稳定性:H2W强于H2Z | |
| C. | 离子半径由大到小:Z2->X+>Y3+>W2- | |
| D. | W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com