
| A. | 22 mL、12 mL | B. | 13 mL、21 mL | C. | 16 mL、16 mL | D. | 21 mL、13 mL |
分析 NO和O2混合气体充入试管中,然后将试管倒立于水中,发生的反应为:4NO+3O2+2H2O=4HNO3,剩余的气体可能为氧气,也可能为NO,根据反应方程式进行讨论计算出混合气体中NO与O2的体积.
解答 解:发生的反应为:4NO+3O2+2H2O=4HNO3,
若剩余的6mL为NO时,则发生反应的NO和O2的总体积为:34mL-6mL=28mL,其中反应消耗NO为:28mL×$\frac{4}{7}$=16mL,消耗氧气为:28mL-16mL=12mL,则原混合气体中含有NO体积为:16mL+6mL=22mL,含有12mL氧气;
若剩余的6mL为氧气时,则发生反应的NO和O2的总体积为:34mL-6mL=28mL,其中反应消耗NO为:28mL×$\frac{4}{7}$=16mL,消耗氧气为:28mL-16mL=12mL,则原混合气体中含有NO体积为:16mL,含有氧气的体积为:6mL+12mL=18mL;
根据分析可知,正确的为A,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 自来水厂用含铁的化合物作净水剂 | |
| B. | 用丁达尔效应区分氢氧化铁胶体和氯化铁溶液 | |
| C. | 一束平行光照射蛋白质溶液时,从侧面要看到光亮的通路 | |
| D. | 在三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含碳原子数比为1:1 | B. | 体积比为1:1 | ||
| C. | 密度比为7:11 | D. | 分子数比为7:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
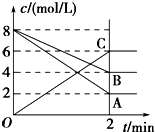 根据图填空:
根据图填空:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,不考虑立体异构)是临床上使用广泛的药物.下图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的药物.下图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)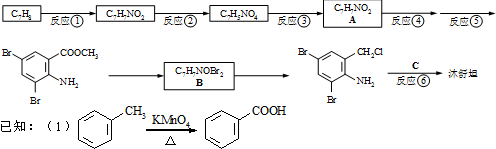
 +2
+2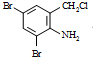 +K2CO3→2
+K2CO3→2 +2KCl+CO2↑+H2O
+2KCl+CO2↑+H2O B
B
 、
、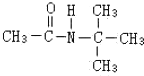
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 4×10-5 | 6×10-5 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 Ni |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com