

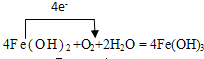 ,元素化合价降低的物质为氧化剂,氧化剂为氧气,元素化合价升高的物质为还原剂,还原剂为氢氧化铁,
,元素化合价降低的物质为氧化剂,氧化剂为氧气,元素化合价升高的物质为还原剂,还原剂为氢氧化铁,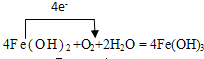 ; 氧气;氢氧化亚铁;
; 氧气;氢氧化亚铁;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+) |
| B、c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L |
| C、c(C2O42-)<c(HC2O4-)<c(H2C2O4) |
| D、c(H+)<c(HC2O4-)<c(C2O42-)<c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子在化学反应中可以再分,原子在化学反应中不可再分 |
| B、氧化性酸具有氧化性,还原性酸不具有氧化性 |
| C、胶体、溶液、浊液均为混合物,电解质、非电解质均为化合物 |
| D、12C、13C、14C为碳元素的三种核素,金刚石、石墨互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+ |
| B、Ba2+ |
| C、C1- |
| D、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2L H2所含的电子数为NA |
| B、3.9g 钾变为离子失去电子的数目为0.1NA |
| C、0.5mol?L-1硫酸钾溶液1L 中含有K+和SO42-离子的总数为NA |
| D、44g CO2含有的分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com