
| A. | 金属性:Li>Na>K>Rb | B. | 酸性:HF<HCl<HBr<HI | ||
| C. | 微粒半径:K+>Na+>Mg2+>Al3+ | D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
分析 A.同主族元素从上到下,元素的金属性逐渐增强;
B.同主族元素对应氢化物的酸性从上到下逐渐增强;
C.电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小;
D.非金属性越强,最高价氧化物对应水合物的酸性越强.
解答 解:A.同主族元素从上到下,元素的金属性逐渐增强,则金属性Li<Na<K<Rb,故A错误;
B.F、Cl、Br、I位于同一主族,原子序数逐渐增大,则酸性逐渐减小,即酸性:HF<HCl<HBr<HI,故B正确;
C.K+含有3个电子层,Na+、Mg2+、Al3+含有2个电子层,钾离子半径最大,电子层相同时,核电荷数越大,离子半径越小,则离子半径大小为:K+>Na+>Mg2+>Al3+,故C正确;
D.非金属性:Cl>S>P>Si,则最高价氧化物对应水合物的酸性:HClO4>H2SO4>H3PO4>H2SiO3,故D正确;
故选A.
点评 本题考查了 原子结构与元素周期律的关系及应用,题目难度不大,涉及离子半径大小比较、酸性强弱判断、金属性强弱比较等知识,明确元素周期律内容为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 278 | B. | 280 | C. | 282 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某白酒中的增塑剂叫邻苯二甲酸二乙酯(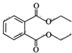 ),对人体健康有害 ),对人体健康有害 | |
| B. | 4-甲基咪唑(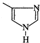 )是某饮料中检测出的致癌物,能使酸性高锰酸钾溶液褪色 )是某饮料中检测出的致癌物,能使酸性高锰酸钾溶液褪色 | |
| C. | 某媒体披露“皮革奶”事件,有不法厂商将皮革下脚料水解后掺入奶粉,以提高奶粉中蛋白质的含量.动物皮革的主要成分是蛋白质,“皮革奶”灼烧时有烧焦羽毛的气味 | |
| D. | 新西兰牛奶中检测出有毒的二氰二氨(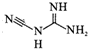 ),该物质一定不溶于水 ),该物质一定不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
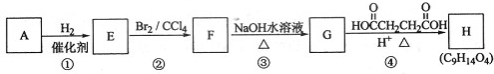
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
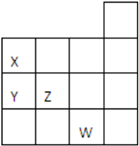 如图所示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述不正确的是( )
如图所示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述不正确的是( )| A. | 只有④ | B. | ①③④ | C. | ②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
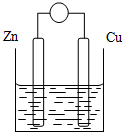 原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.
原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.| 电极 | 电极材料 | 电极反应式 | 反应类型 |
| 正极 | |||
| 负极 | |||
| 总反应式 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体氯化铵和消石灰混合加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O | |
| B. | 硫化亚铁与盐酸反应:S2-+2H+═H2S↑ | |
| C. | 铜与稀硝酸:Cu+4H++2NO3-═Cu2++NO2↑+2H2O | |
| D. | 向氨水中通入过量的二氧化碳:NH3•H2O+CO2═NH4++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
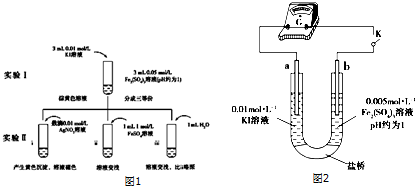
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com