


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
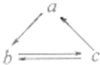 a、b、c是三种都含同一金属元素的物质,它们之间有如图所示的直接转化关系,则a、b、c是
a、b、c是三种都含同一金属元素的物质,它们之间有如图所示的直接转化关系,则a、b、c是查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 N2+3Cu+3H2O.备选仪器装置如下(装置内所发生的反应是完全的).
N2+3Cu+3H2O.备选仪器装置如下(装置内所发生的反应是完全的).

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 碳酸钠可用于治疗胃酸过多 | 碳酸钠可与盐酸反应 |
| B | 金属镁失火能用二氧化碳灭火 | 二氧化碳不支持燃烧 |
| C | 明矾可用于净水 | 明矾水溶液呈酸性 |
| D | 过氧化钠可用作航天员的供氧剂 | Na2O2能与CO2或水反应生成氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
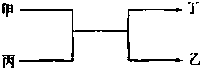 甲、乙为短周期同一主族元素组成的单质,丙、丁为氧化物,它们存在如下转化关系,则满足条件的甲和乙分别为
甲、乙为短周期同一主族元素组成的单质,丙、丁为氧化物,它们存在如下转化关系,则满足条件的甲和乙分别为查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com