
ŃĒĀČĖįÄĘ(NaClO2)ŹĒŅ»ÖÖÖŲŅŖµÄĻū¶¾¼Į£¬Ö÷ŅŖÓĆÓŚĖ®”¢É°ĢĒ”¢ÓĶÖ¬µÄĘÆ°×Óėɱ¾ś”£ŅŌĻĀŹĒÖĘČ”ŃĒĀČĖįÄĘµÄ¹¤ŅÕĮ÷³Ģ£ŗ
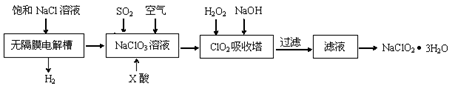
ŅŃÖŖ£ŗ¢ŁClO2ĘųĢåÖ»Äܱ£³ÖŌŚÅØ¶Č½ĻµĶדĢ¬ĻĀŅŌ·ĄÖ¹±¬ÕØŠŌ·Ö½ā£¬ĒŅŠčĻÖŗĻ³ÉĻÖÓĆ”£
¢ŚClO2ĘųĢåŌŚÖŠŠŌŗĶ¼īŠŌČÜŅŗÖŠ²»ÄÜĪČ¶Ø“ęŌŚ”£
(1)ŌŚĪŽøōĤµē½ā²ŪÖŠ³ÖŠųµē½āŅ»¶ĪŹ±¼äŗó£¬Éś³ÉĒāĘųŗĶNaClO3£¬ĒėŠ“³öŃō¼«µÄµē¼«·“Ó¦·½³ĢŹ½ ”£
(2)·“Ӧɜ³ÉClO2ĘųĢåŠčŅŖXĖįĖį»Æ£¬XĖįæÉŅŌĪŖ ”£
A£®ŃĪĖį B£®Ļ”ĮņĖį C£®ĻõĖį D£®H2C2O4ČÜŅŗ
(3)ĪüŹÕĖžÄŚµÄĪĀ¶Č²»ÄܹżøßµÄŌŅņĪŖ ”£
(4)ClO2±»S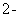 »¹ŌĪŖClO
»¹ŌĪŖClO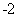 ”¢Cl
”¢Cl ×Ŗ»ÆĀŹÓėpH¹ŲĻµČēĶ¼”£
×Ŗ»ÆĀŹÓėpH¹ŲĻµČēĶ¼”£
Š“³öpH”Ü2Ź±ClO2ÓėS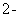 ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ ”£
·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ ”£

(5)ClO2¶ŌĪŪĖ®ÖŠFe2£«”¢Mn2£«”¢S2£ŗĶCN µČÓŠĆ÷ĻŌµÄČ„³żŠ§¹ū”£Ä³¹¤³§ĪŪĖ®ÖŠŗ¬CN
µČÓŠĆ÷ĻŌµÄČ„³żŠ§¹ū”£Ä³¹¤³§ĪŪĖ®ÖŠŗ¬CN amg/L£¬ĻÖÓĆClO2½«CN
amg/L£¬ĻÖÓĆClO2½«CN Ńõ»Æ£¬Éś³ÉĮĖĮ½ÖÖĪŽ¶¾ĪŽŗ¦µÄĘųĢ壬ĘäĄė×Ó·“Ó¦·½³ĢŹ½ĪŖ_______________________£»“¦Ąķ100 m3ÕāÖÖĪŪĖ®£¬ÖĮÉŁŠčŅŖClO2 _____________ mol”£
Ńõ»Æ£¬Éś³ÉĮĖĮ½ÖÖĪŽ¶¾ĪŽŗ¦µÄĘųĢ壬ĘäĄė×Ó·“Ó¦·½³ĢŹ½ĪŖ_______________________£»“¦Ąķ100 m3ÕāÖÖĪŪĖ®£¬ÖĮÉŁŠčŅŖClO2 _____________ mol”£
”¾ÖŖŹ¶µć”湤ŅÕĮ÷³ĢĢāA4B1 H6 F4
”¾“š°ø½āĪö”æ(1)Cl£-6e£+3H2O=ClO3£+6H+ (2)B (3)ĪĀ¶Č¹żøßH2O2½«·Ö½ā
(4)2ClO2+5S2£+8H+=2Cl£+5S”ż+4H2O (5)2ClO2+2CN£=2Cl£+2CO2+N2”ü 100a/26
½āĪö£ŗ£Ø1£©µē½ā³ŲÖŠŃō¼«Ź§Č„µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬¼“ĀČĄė×ÓŌŚŃō¼«Ź§Č„µē×Ó£¬µē¼«·“Ó¦Ź½ŹĒCl£-6e£+3H2O=ClO3£+6H+”£
£Ø2£©ÓÉÓŚClO2ĘųĢåŌŚÖŠŠŌŗĶ¼īŠŌČÜŅŗÖŠ²»ÄÜĪČ¶Ø“ęŌŚ£¬ĖłŅŌÖ»ÄÜŌŚĖįŠŌ»·¾³ÖŠ“ęŌŚ”£ŌŚĖįŠŌĢõ¼žĻĀ£¬ĀČĖįÄĘČŻŅ×ŗĶŃĪĖį”¢H2C2O4·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬¶ųĻõĖįŹĒĒæŃõ»ÆŠŌĖį£¬ĖłŅŌXÓ¦øĆŹĒĮņĖį”£
£Ø3£©ĪĀ¶Č¹żøߣ¬H2O2ČŻŅ×·Ö½ā£¬Ņņ“ĖĪüŹÕĖžµÄĪĀ¶Č²»Äܹżøߣ¬ĘäÄæµÄŹĒ·ĄÖ¹H2O2·Ö½ā”£
£Ø4£©øł¾ŻĶ¼ĻńæÉÖŖ£¬pH”Ü2Ź±ClO2±»»¹ŌĪŖCl”Ŗ£¬ŌņøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ2ClO2+5S2”Ŗ+ 8H+ £½2Cl”Ŗ+5S”ż+4H2O”£
£Ø5£©øł¾ŻĢāŅāÉś³ÉµÄĮ½ÖÖĪŽ¶¾ĪŽŗ¦µÄĘųĢåŹĒµŖĘųŗĶ¶žŃõ»ÆĢ¼£¬
¼“2ClO2+2CN£=2Cl£+2CO2+N2”ü
2mol 52g
xmol 100”Įag/m3£¬x=100a/26
”¾Ė¼Ā·µć²¦”æ½ā“šĮ÷³ĢĢāÖŠµÄŃõ»Æ»¹Ō·“Ó¦µÄÅäĘ½ŅŖĄūÓĆŹŲŗć·Ø£ØŌ×Ó”¢µēŗÉ”¢µĆŹ§µē×Ó£©£¬Čē±¾ĢāµÄµŚ¢ČĢāµÄÅäĘ½£ŗŹ×ĻČøł¾ŻŃõ»Æ»¹Ō·“Ó¦µĆŹ§µē×ÓĻąµČÅäĘ½Ńõ»Æ¼Į”¢»¹Ō¼Į”¢Ńõ»Æ²śĪļŗĶ»¹Ō²śĪļ£ŗ2ClO2+5S2”Ŗ£½2Cl”Ŗ+5S”ż£¬ŌŁøł¾ŻµēŗÉŹŲŗćÅäĘ½2ClO2+5S2”Ŗ+ 8H+ £½2Cl”Ŗ+5S”ż£¬Ō×ÓŹŲŗć×ÜÅäĘ½2ClO2+5S2”Ŗ+ 8H+ £½2Cl”Ŗ+5S”ż+4H2O”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
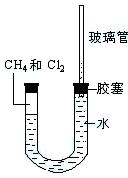 ČēĶ¼ĖłŹ¾£¬UŠĶ¹ÜµÄ×ó¶Ė±»Ė®ŗĶ½ŗČū·ā±ÕÓŠ¼×ĶéŗĶĀČĘų£ØĢå»ż±ČĪŖ1£ŗ4£©µÄ»ģŗĶĘųĢ壬¼Ł¶ØĀČĘųŌŚĖ®ÖŠČܽā¶ČæÉŅŌŗöĀŌ”£½«øĆ×°ÖĆ·ÅÖĆŌŚÓŠ¹āĮĮµÄµŲ·½£¬ČĆ»ģŗĶĘųĢå»ŗĀżµŲ·“Ó¦Ņ»¶ĪŹ±¼ä”£
ČēĶ¼ĖłŹ¾£¬UŠĶ¹ÜµÄ×ó¶Ė±»Ė®ŗĶ½ŗČū·ā±ÕÓŠ¼×ĶéŗĶĀČĘų£ØĢå»ż±ČĪŖ1£ŗ4£©µÄ»ģŗĶĘųĢ壬¼Ł¶ØĀČĘųŌŚĖ®ÖŠČܽā¶ČæÉŅŌŗöĀŌ”£½«øĆ×°ÖĆ·ÅÖĆŌŚÓŠ¹āĮĮµÄµŲ·½£¬ČĆ»ģŗĶĘųĢå»ŗĀżµŲ·“Ó¦Ņ»¶ĪŹ±¼ä”£
£Ø1£©¼ŁÉč¼×ĶéÓėĀČĘų³ä·Ö·“Ó¦£¬ĒŅÖ»²śÉśŅ»ÖÖÓŠ»śĪļ£¬ĒėŠ“³ö»Æѧ·½³ĢŹ½ ”£
£Ø2£©¾¹ż¼øøöŠ”Ź±µÄ·“Ó¦ŗó£¬UŠĶ¹Ü×ó¶Ė²śÉśµÄĻÖĻóŹĒ£ŗ _______”¢_______”¢______ÓŅ¶ĖµÄ²£Į§¹ÜÖŠĖ®Öł±ä»ÆŹĒ ”£
£Ø3£©ŹŌ½āŹĶUŠĶ¹ÜÓŅ¶ĖµÄ²£Į§¹ÜÖŠĖ®Öł±ä»ÆµÄŌŅņ ”£
£Ø4£©ŌŚ·“Ӧɜ³ÉĪļÖŠ£ŗ³£ÓĆ×÷ÓŠ»śČܼĮµÄŹĒ_______”¢ £¬³£ÓĆ×÷Ćš»š¼ĮµÄŹĒ £»______·Ö×ÓÖ»ÓŠŅ»ÖÖ½į¹¹µÄŹĀŹµÄÜÓŠŠ§Ö¤Ć÷CH4ŹĒ ½į¹¹¶ų·ĒĘ½ĆęÕż·½ŠĪ½į¹¹”£
£Ø5£©Š“³ö·ūŗĻĻĀĮŠĢõ¼žµÄ¼×ĶéµÄŅ»ÖÖĶ¬ĻµĪļµÄ½į¹¹¼ņŹ½
A.ĒāŌ×ÓŹżĪŖŹ®¶ž B.Ņ»ĀČČ”“śĪļÖ»ÓŠŅ»ÖÖ½į¹¹
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĖÄÖÖ¶ĢÖÜĘŚŌŖĖŲW”¢X”¢Y”¢ZµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ĘäŌ×ÓµÄ×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ19£¬WŗĶXŌŖĖŲŌ×ÓÄŚÖŹ×ÓŹżÖ®±ČĪŖ1:2£¬X2+ŗĶZ-Ąė×ӵĵē×ÓŹżÖ®²īĪŖ8£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ ( )
A£®ÓėWĻąĮŚµÄĶ¬Ö÷×åŌŖĖŲæÉÖĘ³ÉÖŲŅŖµÄ°ėµ¼Ģå²ÄĮĻ
B£®Xµ„ÖŹ²»æÉÄÜÖĆ»»³öWµ„ÖŹ
C£®ŌŖĖŲŌ×Ó°ė¾¶“ӓ󵽊”µÄĖ³ŠņŹĒX”¢Y”¢Z
D£®W”¢Y”¢ZŌŖĖŲ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļÖŠĖįŠŌ×īĒæµÄŹĒHZO4
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
°“ŅŌĻĀŹµŃé·½°øæÉ“Óŗ£Ńó¶ÆĪļ±śŗ£ĒŹÖŠĢįČ”¾ßÓŠæ¹Ö×Įö»īŠŌµÄĢģČ»²śĪļ”£
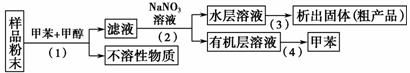
ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø £©
A£®²½Öč(1)ŠčŅŖ¹żĀĖ×°ÖĆ B£®²½Öč(2)ŠčŅŖÓƵ½·ÖŅŗĀ©¶·
C£®²½Öč(3)ŠčŅŖÓƵ½ŪįŪö D£®²½Öč(4)ŠčŅŖÕōĮó×°ÖĆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½«51.2gCuĶźČ«ČÜÓŚŹŹĮæÅØĻõĖįÖŠ£¬ŹÕ¼Æµ½µŖµÄŃõ»ÆĪļ£Øŗ¬NO”¢N2O4”¢NO2£©µÄ»ģŗĻĪļ¹²0.8mol£¬ÕāŠ©ĘųĢåĒ”ŗĆÄܱ»500ml 2mol/LNaOHČÜŅŗĶźČ«ĪüŹÕ£¬Éś³Éŗ¬NaNO3ŗĶNaNO2µÄŃĪČÜŅŗ£¬ĘäÖŠNaNO2µÄĪļÖŹµÄĮæĪŖ£Ø £©
A£®0.2mol B£®0.6mol C£®0.8mol D£®1.0mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¶ŌĶ”ŖŠæ”ŖĻ”ĮņĖį×é³ÉµÄŌµē³Ų×°ÖĆÖŠ£¬µ±µ¼ĻßÖŠÓŠ1molµē×ÓĶعżŹ±£¬ĄķĀŪÉĻµÄĮ½¼«±ä»ÆŹĒ¢ŁŠæʬČܽāĮĖ32.5æĖ ¢ŚŠæʬŌöÖŲĮĖ32.5æĖ ¢ŪĶʬÉĻĪö³ö1æĖĒāĘų¢ÜĶʬÉĻĪö³ö1molĒāĘų
A£® ¢Ł¢Ū B£®¢Ł¢Ü C£® ¢Ś¢Ū D£® ¢Ś¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚ·“Ó¦2SO2£«O2 2SO3ÖŠ£¬ÓŠa mol SO2ŗĶb mol O2²Ī¼Ó·“Ó¦£¬“ļµ½»ÆŃ§Ę½ŗāדĢ¬Ź±ÓŠc mol SO3Éś³É£¬ŌņSO2ŌŚĘ½ŗā»ģŗĻĪļÖŠµÄĢå»ż·ÖŹżĪŖ
2SO3ÖŠ£¬ÓŠa mol SO2ŗĶb mol O2²Ī¼Ó·“Ó¦£¬“ļµ½»ÆŃ§Ę½ŗāדĢ¬Ź±ÓŠc mol SO3Éś³É£¬ŌņSO2ŌŚĘ½ŗā»ģŗĻĪļÖŠµÄĢå»ż·ÖŹżĪŖ
A.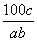 ”Į100% B.
”Į100% B.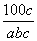 ”Į100%
”Į100%
C.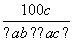 ”Į100% D.
”Į100% D. %
%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijŌŖĖŲµÄŅ»ÖÖĶ¬Ī»ĖŲXµÄŌ×ÓÖŹĮæŹżĪŖA£¬ŗ¬NøöÖŠ×Ó£¬ĖüÓė1HŌ×Ó×é³ÉHmX·Ö×Ó”£ŌŚa g HmXÖŠĖłŗ¬ÖŹ×ÓµÄĪļÖŹµÄĮæŹĒ(””””)
A. 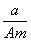 (A£N£«m) mol B.
(A£N£«m) mol B. 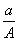 (A£N) mol
(A£N) mol
C. 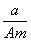 (A£N) mol D.
(A£N) mol D. 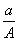 (A£N£«m) mol
(A£N£«m) mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 ijĻ”ĮņĖįŗĶĻ”ĻõĖįµÄ»ģŗĻČÜŅŗ200 mL£¬Ę½¾ł·Ö³É Į½·Ż£¬ĻņĘäÖŠŅ»·ŻÖŠÖš½„¼ÓČėĶ·Ū£¬×ī¶ąÄÜČܽā19.2 g£ØŅŃÖŖĻõĖįÖ»Äܱ»»¹ŌĪŖNOĘųĢ壩”£ĻņĮķŅ»·ŻÖŠÖš½„¼ÓČėĢś·Ū£¬²śÉśĘųĢåµÄĮæĖęĢś·ŪÖŹĮæŌö¼ÓµÄ±ä»ÆČēĶ¼ĖłŹ¾”£ĻĀĮŠ·ÖĪö»ņ½į¹ū“ķĪóµÄŹĒ
ijĻ”ĮņĖįŗĶĻ”ĻõĖįµÄ»ģŗĻČÜŅŗ200 mL£¬Ę½¾ł·Ö³É Į½·Ż£¬ĻņĘäÖŠŅ»·ŻÖŠÖš½„¼ÓČėĶ·Ū£¬×ī¶ąÄÜČܽā19.2 g£ØŅŃÖŖĻõĖįÖ»Äܱ»»¹ŌĪŖNOĘųĢ壩”£ĻņĮķŅ»·ŻÖŠÖš½„¼ÓČėĢś·Ū£¬²śÉśĘųĢåµÄĮæĖęĢś·ŪÖŹĮæŌö¼ÓµÄ±ä»ÆČēĶ¼ĖłŹ¾”£ĻĀĮŠ·ÖĪö»ņ½į¹ū“ķĪóµÄŹĒ
A£®Ō»ģŗĻŅŗÖŠNO3-µÄĪļÖŹµÄĮæĪŖ0.2mol
B£®OA¶Ī²śÉśŹĒNO£¬AB¶Ī·“Ó¦ĪŖ2Fe3++Fe = 3Fe2+£¬BC¶Ī²śÉśĒāĘų
C£®ČÜŅŗÖŠ×īÖÕČÜÖŹĪŖFeSO4
D£®c(H2SO4)ĪŖ5mol”¤L£1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com