
在下列变化中,需要加入合适的氧化剂才能实现的是( )
A.HCl→H2 B.CO2→CO
C.Fe2O3→Fe D.Br-→Br2
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.锥形瓶可用作加热的反应器
B.室温下,不能将浓硫酸盛放在铁桶中
C.配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高
D.用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铜水溶液呈酸性,属保护性无机杀菌剂,对人畜比较安全,其与石灰乳混合可得“波尔多液”。实验室里需用480 mL 0.10 mol·L-1的硫酸铜溶液,则应选用的容量瓶规格和称取溶质的质量分别为 ( )
A.480 mL容量瓶,称取7.68 g硫酸铜
B.480 mL容量瓶,称取12.0 g胆矾
C.500 mL容量瓶,称取8.00 g硫酸铜
D.500 mL容量瓶,称取12.5 g胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.1 mol·L-1NaOH溶液450 mL和
0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器名称)。

(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为_________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 __0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度 0.1 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
_______mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.195 g锌粉加入到20.0 mL的0.100 mol·L-1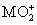 溶液中,恰好完全反应,则还原产物可能是( )
溶液中,恰好完全反应,则还原产物可能是( )
A.M B.M2+ C.M3+ D. MO2+
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=﹣870.3kJ•mol﹣1
(2)C(s)+O2(g)=CO2(g)△H2=﹣393.5kJ•mol﹣1
(3)H2(g)+ O2(g)=H2O(l)△H3=﹣285.8kJ•mol﹣1
O2(g)=H2O(l)△H3=﹣285.8kJ•mol﹣1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的△H为( )kJ•mol﹣1.
|
| A. | +488.3 | B. | ﹣244.15 | C. | ﹣488.3 | D. | +244.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有反应:mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为 热反应,且m+n p(填“>”“=”“<”).
(2)减压时,A的质量分数 .(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率 ,B的转化率 .
(4)若升高温度,则平衡时B、C的浓度之比将 .
(5)若加入催化剂,平衡时气体混合物的总物质的量 .
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色 ,而维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是()
A. 乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液
B. 乙醇(水):加入新制生石灰,蒸馏
C. 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液
D. 乙酸(乙醇):加入金属钠,蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com