
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
已知一定条件下断裂或生成某些化学键的能量变化如表中所示:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨气在化肥、致冷剂、有机合成工业中都有广泛应用.
氨气在化肥、致冷剂、有机合成工业中都有广泛应用.
| ||
| ||
| 催化剂 |
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
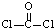 ,则COCl2分子内含有
,则COCl2分子内含有查看答案和解析>>
科目:高中化学 来源:北京市朝阳区2012届高三上学期期末考试化学试题 题型:013
|
已知一定条件下断裂或生成某些化学键的能量关系如下表:
对于反应:H2(g)+Cl2(g)=2HCl(g),下列说法正确的是 | |
| [ ] | |
A. |
该反应的反应热ΔH>0 |
B. |
生成1 mol HC1时反应放热431 kJ |
C. |
氢气分子中的化学键比氯气分子中的化学键更牢固 |
D. |
相同条件下,氢气分子具有的能量高于氯气分子具有的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com