
| A. | 0.5molH2SO4与0.5molBa(OH)2完全反应所放出的热量,即为中和热 | |
| B. | 加入催化剂,活化分子的百分含量和数目都增大,从而反应速率增大 | |
| C. | NaCl溶液能导电,所以NaCl溶液是电解质 | |
| D. | 牺牲阳极的阴极保护法,是根据电解原理防护金属腐蚀 |
分析 A.在稀溶液中,酸跟碱发生中和反应生成1 mol水且生成可溶性的盐时的反应热叫做中和热;
B.催化剂能降低反应所需活化能,使部分非活化分子转化为活化分子;
C.在水溶液里或熔融状态下能导电的化合物是电解质;
D.牺牲阳极的阴极保护法,是根据原电池原理防护金属腐蚀.
解答 解:A.在稀溶液中,酸跟碱发生中和反应生成1 mol水且生成可溶性的盐时的反应热叫做中和热,该反应中不仅生成1mol水还生成难溶性盐硫酸钡,且硫酸未标明是浓硫酸还是稀硫酸,故A错误;B.催化剂能降低反应所需活化能,使部分非活化分子转化为活化分子,从而活化分子的百分含量和数目都增大,导致反应速率增大,故B正确;
C.在水溶液里或熔融状态下能导电的化合物是电解质,氯化钠溶液是混合物,既不是电解质也不是非电解质,故C错误;
D.牺牲阳极的阴极保护法,是根据原电池原理防护金属腐蚀,外加电流的阴极保护法是根据电解原理保护金属腐蚀,故D错误;
故选B.
点评 本题考查中和热概念、化学反应速率影响因素、电解质概念、金属腐蚀与防护等知识点,为高频考点,侧重考查基本概念及基本原理,易错选项是B,注意:无论电解质还是非电解质都必须是化合物,为易错点.题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 | |
| D. | Fe3+与KSCN产生红色沉淀,铁与水蒸气在高温下的反应产物为Fe3O4和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶. | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 用NaOH标准溶液测定未知度的盐酸时,选用酚酞作指示剂,实验时不小心多加了几滴 | |
| D. | 用标准盐酸测定未知浓度NaOH结束实验,酸式滴定管尖嘴部分有气泡,开始实验时无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子结构示意图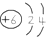 ,可以表示12C原子或13C原子 ,可以表示12C原子或13C原子 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 电子式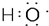 可以表示羟基或氢氧根离子 可以表示羟基或氢氧根离子 | |
| D. | CO2的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
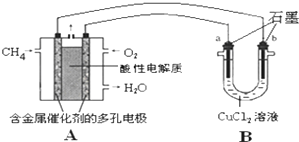
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com