
| 观点 | 是否正确 | 简述理由 |
| 学生1 | 否 | |
| 学生2 | ||
| 学生3 |
| △ |
| 电解 |
| 2800℃ |
| △ |
| C真空 |
| 1352℃ |
| ①过量盐酸 |
| ②△ |
| 电解 |
| 714℃ |
| 盐酸 |
| 活泼金属 |
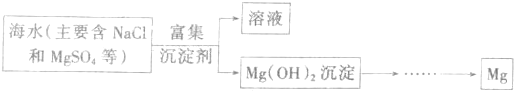
| 海水中氯化镁浓度太小,直接加沉淀剂几乎不产生Mg(OH)2沉淀 | ||
| 否 | 高温蒸发海水后会使NaCl过饱和而析出,从而使Mg(OH)2沉淀中混有较多NaCl杂质 | |
| 是 | 镁离子富集浓度高,成本低 |


科目:高中化学 来源: 题型:
| A、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
| C、向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| D、用小苏打类药物治疗胃酸过多:HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O |
| B、Zn+2HCl═ZnCl2+H2↑ |
| C、NaOH+HCl═NaCl+H2O |
| D、CuO+2HCl═CuCl2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):| 化合物 | X | Y | Z |
| 分子中含有的原子个数 | / | 4 | / |
| 摩尔质量/g?mol-l | 32 | 34 | / |
 ,则X的化学式为
,则X的化学式为查看答案和解析>>
科目:高中化学 来源: 题型:
35 17 |
37 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:3Zn+6e-+6OH-═3Zn(OH)2 |
| B、放电时OH-向负极移动 |
| C、充电时每转移3mol电子,阳极有1mol Fe(OH)3被还原 |
| D、充电时阴极反应式为:3Zn(OH)2+6e-+6H+═3Zn+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com