
| A. | 双键、三键中一定含有π键 | |
| B. | 成键原子间原子轨道重叠越多,共价键越牢固 | |
| C. | 因每个原子未成对电子数是一定的,故配对原子个数也一定 | |
| D. | 每一个原子轨道在空间都具有方向性 |
分析 A.双键、三键中均只含1个σ键,其余为π键;
B.成键原子间原子轨道重叠越多,则键长越短;
C.根据共价键的饱和性进行判断;
D.在原子轨道中,除s轨道是球形对称的外,其他原子轨道在空间都有一定的分布特点.
解答 解:A.双键、三键中均只含1个σ键,其余为π键,所以双键中一定有一个σ键、一个π键,三键中一定有一个σ键、两个π键,故A正确;
B.成键原子间原子轨道重叠越多,成键原子间的距离越小,则键长越短,键越牢固,故B正确;
C.每个原子所能提供的未成对电子的数目是一定的,因此在共建键的形成过程中一个原子含有几个未成对电子,通常就能与其他原子的未成对电子配对形成共价键,所以与其配对的原子个数也一定,这是共价键的饱和性,故C正确;
D.s轨道的形状是球形对称的,它无方向性,故D错误;
故选D.
点评 本题考查了共价键的形成及性质,该题是高考考点之一,属于基础性试题的考查,难度不大,注意掌握共价键的特点,该题有利于培养学生的逻辑思维能力和发散思维能力,以及灵活应变能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | d、a、b、c | B. | d、b、a、c | C. | a、b、c、d | D. | a、b、d、c |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;MgF2
;MgF2 .
.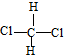 和
和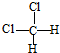
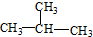
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | Li | C | N | O | F | Ne | ||
| 三 | Na | Mg | S | Cl | ||||
| 四 | K | Ca | Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
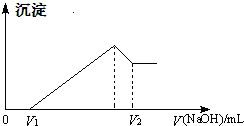 将镁、铝的混合物7.5g溶于100mL 4mol/L的H2SO4溶液中,然后再滴加1mol/L的NaOH溶液.请回答:
将镁、铝的混合物7.5g溶于100mL 4mol/L的H2SO4溶液中,然后再滴加1mol/L的NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
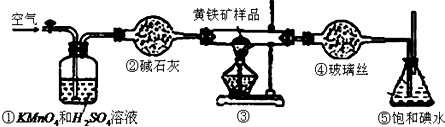
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能/kJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
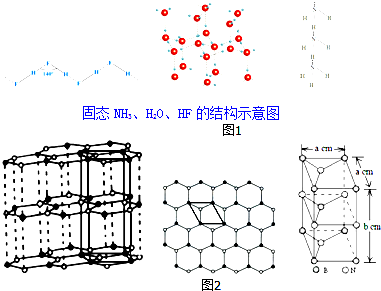
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com