
(19分)某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
I.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
(1)甲同学设计如图装置进行实验:
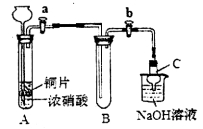
①试管A中反应的离子方程式是___________。
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为__________。
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设正确。则NO2和Na2O2反应的化学方程式是_______________。
II.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2==2NaNO2;2NaNO2+2HCl==2NaCl+NO2↑+NO↑+H2O:酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
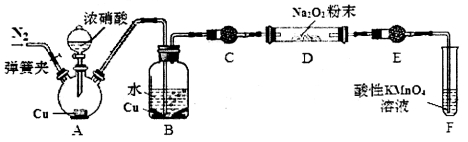
①在反应前,打开弹簧夹,通入一段时间N2,目的是____________________。
②B中观察到的主要现象的是_________(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是______(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为_________________。
⑤充分反应后,检验D装置中产物的方法是:取D装置中产物少许,__________________,则产物是NaNO2。
(19分)
(1)Cu+4H++2NO3-===Cu2++2NO2↑+2H2O(3分) 干燥管(2分)
(2)除去NO2中混有的水蒸气(2分) Na2O2+2NO2===2NaNO3 (2分)
(3)①将装置中的空气排出(2分) ②ac (2分) ③a (2分)
④3:5(2分) ⑤加入稀盐酸,产生红棕色气体 (2分)
【解析】
试题分析:(1)试管A中Cu与浓硝酸反应,反应的离子方程式是:Cu+4H++2NO3-===Cu2++2NO2↑+2H2O;根据实验装置图,仪器C的名称为干燥管。
(2)因为NO2能与H2O反应,所以在A、B之间应增加一个除去NO2中混有的水蒸气的装置;红棕色气体迅速消失;带火星的木条未复燃,则NO2被Na2O2氧化,所以化学方程式为:Na2O2+2NO2===2NaNO3
(3)①反应前,装置内含有空气,所以打开弹簧夹,通入一段时间N2,可把装置中的空气排出。
②实验装置B中NO2通入水中,NO2与H2O反应生成稀硝酸和无色气体NO,铜片与稀硝酸反应生成蓝色Cu(NO3)2、NO和H2O,所以答案为ac。
③装置C、E的作用是吸收水分,无水氯化钙、碱石灰、生石灰都具有吸水性,无水硫酸铜常用于水的检验,吸水性较差,故答案为a。
④氧化剂为MnO4,Mn元素由+7价降低为+2价,还原剂为NO,N元素由+2价升高到+3价,根据化合价升高总价数等于降低总价数可得:5n(MnO4)=3n(NO),则n(MnO4):n(NO)=3:5。
⑤NO与Na2O2反应生成NaNO2,D装置中产物为NaNO2,根据反应:2NaNO2+2HCl==2NaCl+NO2↑+NO↑+H2O进行检验,所以检验方法是:取D装置中产物少许,加入稀盐酸,产生红棕色气体,则产物是NaNO2。
考点:本题考查实验方案的设计与评价、基本操作与基本仪器、方程式的书写。
考点分析: 考点1:氧化还原反应 考点2:综合性实验 试题属性

科目:高中化学 来源:2014-2015山东省枣庄市高一上学期期末化学试卷(解析版) 题型:填空题
(7分)生活中为了延长鲜花的寿命,通常会在花瓶中加入“鲜花保鲜剂”。下表是0.5L某种“鲜花保鲜剂”中含有的成分及含量,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.25 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.25 | 158 |
硝酸银 | 0.02 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是___ _____。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为:____ ___ mol·L-1。
(要求用原始数据书写出表达式,不需要化简)
(3)为了研究不同浓度的“鲜花保鲜剂”的保鲜功效,需配制多份不同物质的量浓度的溶液进行研究。现欲配制480mL某物质的量浓度的“鲜花保鲜剂”,所需的玻璃仪器有:烧杯、玻璃棒、________________、____________。(在横线上填写所缺仪器的名称)
(4)配制上述“鲜花保鲜剂”时,其正确的操作顺序是(用字母表示,每个操作只用一次): ;
A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入适量水溶解
C.将烧杯中的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
E.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G.用电子天平称量各组成成分,并把它们放入烧杯中混合
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是:____ ______。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“鲜花保鲜剂”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省新余市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中能大量共存的是
A.无色溶液中:K+、Na+、MnO4—、SO42—
B.在酸性溶液中:Ba2+、Na+、SO42—、Cl—
C.加入Al能放出H2的溶液中:Cl—、HCO3—、SO42—、NH4+
D.含大量Fe2+溶液中:K+、Cl—、SO42-、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省遂宁市高三第二次诊断考试化学试卷(解析版) 题型:填空题
(14分)钨是我国丰产元素,也是熔点最高的金属,被誉为“光明使者”。用黑钨矿[FeWO4、MnWO4(W为+6价)]结合其它化工生产高纯钨的化工流程如下。已知H2WO4是不溶于水的弱酸,受热可分解生成氧化物。请回答下列有关问题:
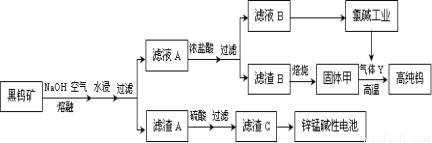
(1)上述流程中通入空气的目的是 ;
(2)滤渣A与硫酸反应的离子方程式为 ;
(3)实验室用锌锰碱性电池作做电源模拟氯碱工业的装置如下图:
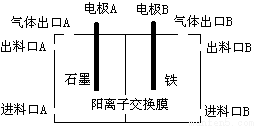
已知:锌锰碱性电池的总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,则锌锰碱性电池的锌电极应与装置中电极 (填“A”或“B”)相接,气体Y为气体出口 (填“A”或“B”)出来的气体,为提高生产效率,电解开始时,从进料口B加入的物质为 ,写出锌锰碱性电池正极反应式 ;
(4)已知:单质碳也可与固体甲制得钨,用气体Y而不用单质碳的原因 ;
(5)将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(1) ΔH2=-285.8 kJ/mol
H2O(1) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省遂宁市高三第二次诊断考试化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列叙述正确的是
A.标况下,2.8 L丙烷中含有的极性共价键数为NA
B.在反应KIO3 + 6HI = KI + 3I2 + 3H2O 中,每生成3 mol I2转移的电子数为6 NA
C.已知CH3COONH4溶液的PH=7,则1L 0.1mol/L的CH3COONH4溶液中,CH3COO- 数为0.1NA
D.39g Na2O2和Al(OH)3的混合物中阴、阳离子的总数为2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三3月模拟考试理综化学试卷(解析版) 题型:选择题
阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为:下列说法正确的是
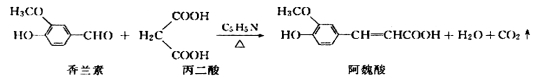
A.阿魏酸的分子式为C10H10O4
B.香兰素、阿魏酸均可与NaOH、NaHCO3溶液反应
C.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
D.一定条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:
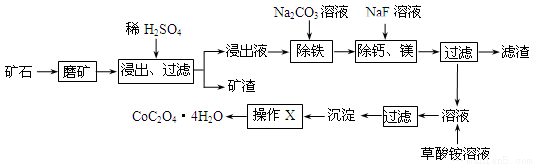
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。

(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4;
CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2 + C6  CoO2 + LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2 + LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
下列溶液中有关物质的浓度关系正确的是
A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液:c(NH4HSO4) > c( (NH4)2SO4)> c(NH4Cl)
B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-) = c(HCO3-) + c(H2CO3) + c(CO32-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三3月月考理综化学试卷(解析版) 题型:选择题
从化学看生活,你认为合理的说法是
A.塑料制品长期不使用也会老化
B.碱性食品是健康食品
C.燃烧产生烧蕉羽毛味的布料是纯羊毛制品
D.烧酒中最多的分子是乙醇分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com