
【题目】碳、氮、氧、氟、钙、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1) 将乙炔(C2H2)通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。1个乙炔分子中σ键数目为___________,基态Cl原子的核外电子排布式为__________,[Cu(NH3)4] 2+中Cu 2+的配位数为___________。
(2)NF3是微电子工业中优良的等离子刻蚀气体。元素第一电离能N___________F(填“>”“<”或“=”), NF3中氮原子的杂化轨道类型为____________________,NF3分子的空间构型___________。
(3)氮的氧化物中与CO2互为等电子体的分子为___________(写化学式)。
【答案】3 1s22s22p63s23p5 4 < sp3杂化 三角锥形 N2 O
【解析】
(1)乙炔分子结构式为H-C≡C-H,据此判断σ键的数目;Cl原子核外有17个电子,据此书写电子排布式;[Cu(NH3)4]2+中 Cu2+与4个NH3形成配位键,据此判断配位数;
(2)同周期主族元素随原子序数增大元素第一电离能呈增大趋势,但IIA族、VA族元素第一电离能高于同周期相邻元素的;根据价层电子对个数=σ键个数+孤电子对个数计算判断;
(3)原子总数相等、价电子总数也相等的微粒互为等电子体,据此分析解答。
(1)乙炔分子结构式为H-C≡C-H,单键为σ键,三键含有1个σ键、2个π键,1个乙炔分子中σ键数目为3;Cl原子核外有17个电子,电子排布式为:1s22s22p63s23p5;[Cu(NH3)4]2+中 Cu2+与4个NH3形成配位键,配位数为4,故答案为:3;1s22s22p63s23p5;4;
(2)同周期主族元素随原子序数增大元素第一电离能呈增大趋势,但IIA族、VA族元素第一电离能高于同周期相邻元素的,故第一电离能N<F;NF3中氮原子孤电子对数=![]() =1,价层电子对数=1+3=4,即杂化轨道数目为4,N原子采取sp3杂化,分子空间构型为三角锥形结构,故答案为:<;sp3杂化;三角锥形;
=1,价层电子对数=1+3=4,即杂化轨道数目为4,N原子采取sp3杂化,分子空间构型为三角锥形结构,故答案为:<;sp3杂化;三角锥形;
(3) 互为等电子体的微粒具有相等的原子数和价电子数,氮的氧化物中与CO2互为等电子体的分子为N2 O,故答案为:N2 O。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】瑞德西韦(Remdesivir)是一种核苷类似物,具有抗病毒活性,对新型冠状病毒(2019-nCoV)病例展现出较好的疗效。其结构如图a所示,回到下列问题:
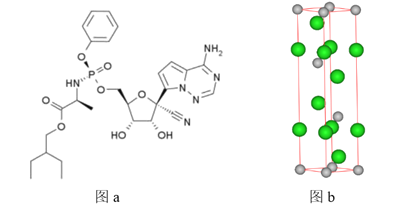
(1)该结构中P原子价电子的轨道表示式为_________。
(2)该结构中处于第二周期原子第一电离能从大到小的顺序为_______(用化学用语回答)。
(3)该结构氨基中N的杂化方式为_________,该分子间的作用力有________。
(4)苯酚(C6H5OH)为合成反应物之一,苯酚的晶体类型是_________,与甲苯(![]() )的相对分子质量相近,但苯酚的熔沸点高于甲苯,原因是________。
)的相对分子质量相近,但苯酚的熔沸点高于甲苯,原因是________。
(5)某镨(59Pr)的化合物是合成该分子的催化剂之一,则镨元素位于元素周期表中的__________区。MgCl2也是合成瑞德西韦的催化剂,晶胞如图b所示,则Mg2+处于氯离子围成的___________空隙中。晶胞参数为acm、acm、bcm,则该晶体的密度为_____________g/cm3。(填表达式,已知底面夹角分别为120°、60°,侧面与底面垂直)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:①M的焰色反应呈黄色。②五种盐均能溶于水,水溶液均为无色。③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。请回答下列问题:
(1)五种盐中,所含阴离子相同的两种盐的化学式是______________。
(2)M溶液显碱性的原因是(用离子方程式表示)_______________________。
(3)X和Z的溶液反应的离子方程式是______________________________。
(4)N和氨水反应的离子方程式是_____________________________________。
(5)若要检验Y中所含的阳离子,正确的实验方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是近年来采用的锅炉水添加剂,其结构式如图,A能除去锅炉水中溶解的氧气,下列说法正确的是( )
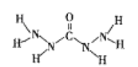
A. A分子中所有原子都在同一平面内
B. A分子中所含的σ键与π键个数之比为10:1
C. 所含C、N均为sp2杂化
D. A与O2反应生成CO2、N2、H2O的物质的量之比为1:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管试验”具有简易、方便、节约、绿色等优点。观察下列四个“封管试验”(夹持装置未画出),判断下列说法正确的是( )
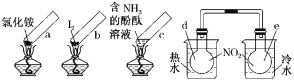
A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.水浴时,d内气体颜色变浅,e内气体颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
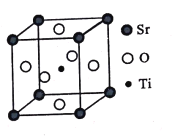
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为____。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为____
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是_____;
③NH4Cl中存在的作用力有_____,NH4Cl熔沸点高于CH3CH2OH的原因是_____,Ti(OCH2CH3)4分子中C原子的杂化形式均为 ____。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于____位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为_____ m(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数。已知C2H4和C4H8的混合物的质量为ag ,下列说法正确的( )
A. 燃烧时消耗的O2一定是33.6a/14 LB. 所含碳氢键数目为2aNA/7
C. 所含氢原子总数为3aNA/14D. 所含共用电子对数目为3a NA /14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法中正确的是( )
A.0.5mol雄黄(As4S4,已知As和N同主族,结构如图)含有NA个S-S键
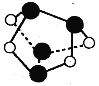
B.合成氨工业中,投料1mol[N2(g)+3H2(g)]可生成2NA个[NH3(g)]
C.用惰性电极电解1L浓度均为2molL-1的AgNO3与Cu(NO3)2的混合溶液,当有0.2NA个电子发生转移时,阴极析出6.4g金属
D.273K,101kPa下,1mol过氧化氢分子中含有的共用电子对数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在方框内填入有机物的结构简式,并回答有关问题:
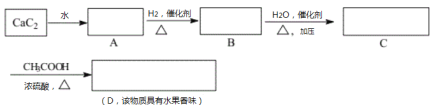
(1)写出A、B、C、D的结构简式:A:___________ B:____________C:___________ D:____________
(2)A→B的化学反应方程式是___________________________,反应类型是___________。
(3) C→D的化学反应方程式是___________________________,反应类型是___________。
(4)B在一定条件下可生成聚合物,其化学方程式是___________________,反应类型是_________。这种塑料会造成白色污染的原因是____________________________。
(5)A在一定条件下也可生成聚合物![]() ,人们发现这种聚合物可以导电,从而具有巨大的应用前景。这一发现在思想观念上给我们的启示是_______________________________________________。
,人们发现这种聚合物可以导电,从而具有巨大的应用前景。这一发现在思想观念上给我们的启示是_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com