
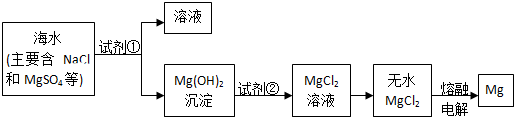
分析 向海水中加入沉淀剂,镁离子转化为Mg(OH)2,采用过滤的方法分离溶液和Mg(OH)2,Mg(OH)2将溶于稀盐酸得到MgCl2溶液,将MgCl2溶液在HCl氛围中蒸干得到MgCl2固体,电解熔融MgCl2固体得Mg,
(1)利用复分解反应及MgSO4转化为Mg(OH)2时阴离子的变化来选择试剂;
(2)根据框图从氢氧化镁到氯化镁的反应分析,制备氯化镁需要加入过量盐酸溶解氢氧化镁为氯化镁溶液;
(3)A、海水沉淀是镁离子结合氢氧根离子生成氢氧化镁沉淀;
B、氢氧化镁溶于盐酸生成氯化镁溶液;
C、固体熔融的氯化镁电解生成镁和氯气;
(4)海水嗮盐后的母液浓缩蒸发,加入沉淀剂氢氧化钙沉淀镁离子.
解答 解:(1)使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择NaOH溶液,为了使镁离子完全转化,加入试剂①的量应过量,
故答案为:NaOH溶液;过量;
(2)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,所以离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:盐酸;过量;
(3)A、海水沉淀是镁离子结合氢氧根离子生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓;
B、氢氧化镁溶于盐酸生成氯化镁溶液,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,
C、氯化镁电解为分解反应,产物为镁和氯气,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(4)海水嗮盐后的母液浓缩蒸发,加入沉淀剂氢氧化钙沉淀镁离子,可以起到富集镁离子的作用,故答案为:C.
点评 本题考查了从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
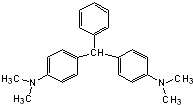 无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药),因为具有潜在致癌性,已被禁止使用.下列关于无色孔雀石绿的叙述中,正确的是( )
无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药),因为具有潜在致癌性,已被禁止使用.下列关于无色孔雀石绿的叙述中,正确的是( )| A. | 分子中所有的碳原子可能在同一平面上 | |
| B. | 无色孔雀石绿属于烃 | |
| C. | 无色孔雀石绿可与溴水中的溴发生加成反应 | |
| D. | 在一定条件下,1mol无色孔雀石绿可以和9mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用明矾使悬浮颗粒沉降下来 | B. | 用漂白粉进行消毒杀菌 | ||
| C. | 只要无色透明,就可以放心饮用 | D. | 饮用前加热煮沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 | |
| B. | 可用酒精萃取碘水中的I2 | |
| C. | 在碘水中加入几滴淀粉溶液,溶液变蓝色 | |
| D. | 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无单质参加的化合反应有可能是氧化还原反应 | |
| B. | Al既能溶于强酸,又能溶于强碱,所以说明“Al既有金属性,又有非金属性” | |
| C. | 青铜是人类在生产生活中使用最早的合金 | |
| D. | 硅在自然界中只以化合态形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
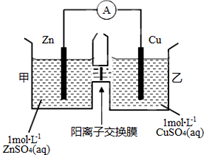 锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述不正确的是( )
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述不正确的是( )| A. | Zn电极上发生氧化反应 | |
| B. | 电子的流向为Zn→电流表→Cu | |
| C. | SO42-由乙池通过离子交换膜向甲池移动 | |
| D. | 电池工作一段时间后,乙池溶液的总质量明显增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
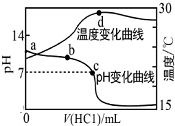 室温下,向a点(pH=a)的20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
室温下,向a点(pH=a)的20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )| A. | 将此氨水稀释,溶液的导电能力减弱 | |
| B. | b点溶液中离子浓度大小可能存在:c(NH${\;}_{4}^{+}$)>c(Cl-)>c(OH-)>c(H+) | |
| C. | c点时消耗盐酸体积V(HCl)<20.00mL | |
| D. | a、d两点的溶液,水的离子积Kw(a)>Kw(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaCl固体 | B. | 滴加少量硫酸铜溶液 | ||
| C. | 加入少量水 | D. | 加入少量CH3COONa固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com