
【题目】下列说法中正确的是( )
A. 离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B. 金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C. 分子晶体的熔沸点低,常温下均呈液态或气态
D. 原子晶体中的各相邻原子都以共价键相结合
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe](橙黄色粉末,不溶于水,易溶于乙醚等有机溶剂)及其衍生物在工业、农业、医药、航天、节能、环保等行业具有广泛地应用。某校课外小组依据反应2KOH+2C5H6+FeCl2=(C5H5)2Fe+2KCl+2H2O在绝对无水、无氧的条件下制备二茂铁。
回答下列问题:
(1)甲组同学拟制备无水FeCl2,主要实验流程为:

步骤I用饱和Na2CO3溶液浸泡的目的是_______;步骤II 中铁屑是过量的,其目的是_____;步骤IV脱水的方法是____________。
(2)乙组用环戊二烯二聚体(沸点为174℃)制备环戊二烯(沸点为419℃),已知:(C5H6)2(环戊二烯二聚体)![]() 2C5H6(环戊二烯)。分离得到环戊二烯的操作方法为________。
2C5H6(环戊二烯)。分离得到环戊二烯的操作方法为________。
(3)丙组同学制备二茂铁的装置如图所示(夹持装置已略去)。

已知:二甲基亚砜的结构式为 ,热稳定性好,能溶解大多数有机物。
,热稳定性好,能溶解大多数有机物。
①图中冷却水从接口______进入(填“a”或“b”)。
②装药品前及整个过程需通入干燥的A,装药品前通入N2的目的是_________。
③反应后分离出上层橙黄色乙醚清液,先用盐酸洗涤,其目的是_______;再用水洗,水洗时能说明已洗涤干净的依据是_________;洗涤后得到的二茂铁乙醚溶液获得二茂铁固体可采用的操作方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子检验的说法正确的是
A. 加入稀盐酸产生无色气体,气体能使澄清石灰水变浑浊,原溶液中一定含有CO![]()
B. 加入稀盐酸无明显现象,再加入硝酸银溶液产生白色沉淀,原溶液中一定含有Cl―
C. 加入BaCl2溶液产生白色沉淀,再加入稀盐酸沉淀不溶解,原溶液中一定含有SO![]()
D. 加入KSCN溶液,呈现血红色,原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及H2O、Cr2O72―、NO2―、H+、NO3―、Cr3+六种微粒,已知反应过程中NO2-浓度变化如图所示,下列说法不正确的是
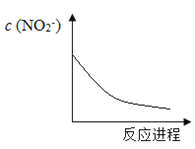
A. Cr2O72-中Cr化合价是+6价
B. 反应的氧化产物是NO3-
C. 消耗1mol氧化剂,转移电子6mol
D. 随着反应的进行,溶液中的H+ 浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。
I. 用纯净的碳酸钠固体配制500mL 0.40mol/L Na2CO3溶液。
(1)称取Na2CO3固体的质量是______________________g。
(2)配制溶液时,进行如下操作,按照操作顺序,第4步是_________(填字母)。
a. 定容 b. 计算 c. 溶解 d. 摇匀 e. 转移 f. 洗涤 g. 称量
(3)下列说法中,正确的是_____________________(填字母)。
a. 定容时,仰视刻度线,会导致配制的溶液浓度偏小
b. 定容时,如果加水超过刻度线,要用滴管吸出
c. 转移时,溶液倒出容量瓶外,要重新配制溶液
d. 摇匀后,液面低于刻度线,要再加水至刻度线
II. 某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:

(1)工业生产纯碱的第一步是除去饱和食盐水的中SO42―、Ca2+离子,依次加入的试剂及其用量是 ______________、 _______________、 (过滤)、 _______________。
(2)已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
①写出装置I中反应的化学方程式________________________________________。
②写出装置II中发生反应的化学方程式________________________________。
(3)该流程中可循环利用的物质是__________________。
(4)制出的纯碱中只含有杂质NaCl。
①检验用该纯碱配制的溶液中含有Cl―的方法是_________________________。
②测定该纯碱的纯度,下列方案中可行的是__________(填字母)。
a. 向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b. 向m克纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c. 向m克纯碱样品中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:

下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3 | V2O74 | VO43 |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是______。
(2)酸浸: ① Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是______。
② 酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据如图推测,酸浸时不选择更高酸度的原因是______。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
① 浸出液中加入石灰乳的作用是______。
② 已知CaCO3的溶解度小于Ca3(VO4)2。向Ca3(VO4)2沉淀中加入(NH4)2CO3溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:______。
③ 向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是______。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2+ + 2H+ + Fe2+ == VO2+ + Fe3+ + H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知 MnO4被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是______。(V2O5的摩尔质量:182 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洁厕灵和84消毒液混合使用会发生反应:![]() ,生成有毒的氯气。
,生成有毒的氯气。![]() 代表阿伏加德罗常数的值,下列说法正确的是
代表阿伏加德罗常数的值,下列说法正确的是
A. 每生成1mol氯气,转移的电子数为![]()
B. 1molNaCl含有的电子数为![]()
C. Cl2只作还原产物
D. 标准状况下,将![]() 溶解在
溶解在![]() 水中,形成
水中,形成![]() 的盐酸
的盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com