
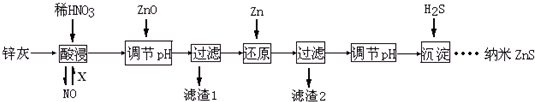
| A. | 酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++NO${\;}_{3}^{-}$═3Fe3++NO↑+5H2O | |
| B. | 将酸浸的尾气循环利用,加入的X气体可以是O2 | |
| C. | 滤渣2中的成分和Zn和Fe | |
| D. | 当溶液中Zn2+浓度为小于1.0×10-5mol•L-1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2-浓度应大于1.6×10-19mol•L-1 |
分析 锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)加入稀硝酸溶解,根据硝酸的强氧化性则所得溶液中含有三价铁、二价锌、二价铜离子,再加入氧化锌调节PH值先使三价铁以氢氧化铁沉淀而过滤除去,再加锌置换溶液中铜而过滤除去,最后调节PH再使锌离子转化成氢氧化锌沉淀,再用硫化氢溶解沉淀氢氧化锌得到ZnS,
A、酸浸时FeO与稀HNO3反应根据稀硝酸的强氧化性书写离子方程式;
B、根据稀硝酸酸浸的尾气为一氧化氮,结合循环利用进一步再转化成硝酸分析.
C、根据以上分析解答;
D、根据Qc>Ksp,才生成ZnS沉淀计算;
解答 解:A、由于稀硝酸的强氧化性,所以FeO与稀HNO3反应离子方程式为:3FeO+10H++NO3-=3Fe3++NO↑+5H2O,故A正确;
B、稀硝酸酸浸的尾气为一氧化氮,根据要循环利用则将NO进一步再转化成硝酸即4NO+3O2+2H2O=4HNO3,所以通空气或者氧气,将酸浸的尾气循环利用,加入的X气体可以是O2,故B正确;
C、由于硝酸的强氧化性则酸溶解所得溶液中含有三价铁、二价锌、二价铜离子,再加入氧化锌调节PH值先使三价铁以氢氧化铁沉淀而过滤除去,再加锌置换成溶液中铜而过滤除去,所以最终过量出来的处理置换出的铜还有过量的锌,故C错误;
D、当Qc>Ksp,才生成ZnS沉淀,即S2-浓度大于$\frac{Ksp}{C(Z{n}^{2+})}$=$\frac{1.6×1{0}^{-24}}{1×1{0}^{-5}}$=1.6×10-19 mol•L-1,故D正确;
故选C.
点评 本题考查较为综合,涉及氧化还原反应、盐类的水解的应用、物质的分离提纯以及Ksp的计算,侧重于学生的分析能力和实验能力、计算能力的考查,为高频考点和常见题型,题目难度中等,注意把握基础知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 现象相同,沉淀量相等 | B. | 现象相同,沉淀量不等 | ||
| C. | 现象不同,沉淀量相等 | D. | 现象不同,沉淀量不等 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
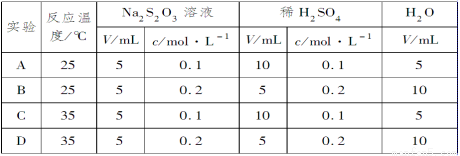
硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ +S↓ + H2O,下列各组实验中最先出现浑浊的是
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
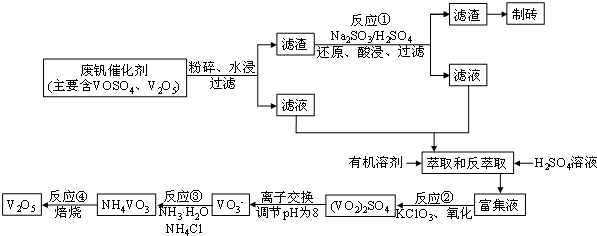
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在转移液体前容量瓶中有少量蒸馏水 | |
| B. | 定容摇匀后,液面已低于容量瓶刻度线,此时再加水 | |
| C. | 转移时有少许液体沿容量瓶外壁流到实验桌上 | |
| D. | 定容时俯视液面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com