
| A、向稀氨水中逐滴加入稀硝酸银溶液配制银氨溶液:Ag++2NH3?H2O=[Ag (NH3)2]++2 H2O |
| B、用双氧水和稀硫酸可以雕刻印刷电路板:Cu+H2O2+2H+=Cu2++2H2O |
| C、硫化钾晶体溶于水:S2-+2H2O?2OH-+H2S |
| D、澄清石灰水与过量苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |


科目:高中化学 来源: 题型:
| A、滴入甲基橙显红色的溶液中:K+、Fe2+、Cl-、NO-3 |
| B、常温时,水电离出的c(H+)=1×10-12mol?L-1的溶液中:K+、AlO-2、CH3COO-、SiO2-3 |
| C、c(OH-)/c(H+)=1012的溶液中:SO2-3、NH+4、NO-3、K+ |
| D、c(SCN-)=0.1 mol?L-1的溶液中:Fe3+、NH+4、NO-3、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
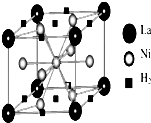 (1)目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.
(1)目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.| 139 |
| 57 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E是原子序数依次增大的五种元素.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B是同周期元素中未成对电子最多的;C的基态原子2p能级有1个单电子;D原子中有两个未成对电子且D的核电核数是A与B的核电核数之和的2倍;F有“生物金属”之称,F4+和氩原子的核外电子排布相同;E与F同周期,价电子数为2.请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
A、B、C、D、E是原子序数依次增大的五种元素.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B是同周期元素中未成对电子最多的;C的基态原子2p能级有1个单电子;D原子中有两个未成对电子且D的核电核数是A与B的核电核数之和的2倍;F有“生物金属”之称,F4+和氩原子的核外电子排布相同;E与F同周期,价电子数为2.请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:
 [化学──选修物质结构与性质]为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准.表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数.结合表中列出的九种气体,试参与回答下列各题:
[化学──选修物质结构与性质]为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准.表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数.结合表中列出的九种气体,试参与回答下列各题:| 序号 | 物质 | 大气中的含量 (体积百分比) |
温室效应指数 |
| (A) | H2 | 2 | 0 |
| (B) | O2 | 21 | 0 |
| (C) | H2O | 1 | 0.1 |
| (D) | CO2 | 0.03 | 1 |
| (E) | CH4 | 2×10-4 | 30 |
| (F) | H2O | 3×10-3 | 160 |
| (G) | O3 | 4×10-5 | 2000 |
| (H) | CCl3F | 2.8×10-8 | 21000 |
| (I) | CCl2F2 | 4.8×10-4 | 25000 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向 NaHS 溶液中通入适量氯气:HS-+Cl2=S↓+H++2Cl- |
| B、向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、将 10 mL 0.1 mol?L-1HCl溶液与20 mL 0.05 mol?L-1 Na3PO4溶液混合3H++2 PO43-=H2PO4-+HPO42- |
| D、向 Mg(HCO3)2溶液中加入过量NaOH 溶液Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液 pH 变化如图所示.下列分析中,正确的是( )
标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液 pH 变化如图所示.下列分析中,正确的是( )| A、ab 段反应是:SO2+2 H2S=3S↓+2 H2O |
| B、亚硫酸是比氢硫酸更弱的酸 |
| C、原H2S溶液的物质的量浓度为0.05 mol?L-1 |
| D、b 点对应的溶液导电性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | 样品质量/g | 沉淀质量/g |
| 1 | 2.23 | 1.0 |
| 2 | 4.46 | ? |
| 3 | 6.69 | 2.5 |
| 4 | 8.92 | 2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.89过氧化钠中含有的离子数为0.4NA |
| B、将0.1molFeCl3水解制成胶体,所得胶体粒子数为0.1NA |
| C、等物质的量的甲基(-CH3)和羟基(-OH)所含电子数相等 |
| D、常温常压下28 g CO与22.4 L O2所含分子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com