
| A. | ①③ | B. | ①②③④ | C. | ②④ | D. | ①③④ |
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
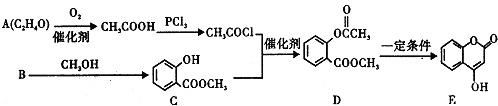
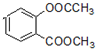 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.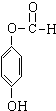 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)3COH的名称:2,2二甲基乙醇 | B. | 乙醛的结构式:CH3CHO | ||
| C. | CH4分子的比例模型: | D. | 聚丙烯的结构简式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
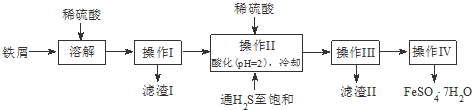
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成1mol ClO2,转移电子数为NA | B. | 该反应为复分解反应 | ||
| C. | H2SO4发生氧化反应 | D. | NaClO3是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
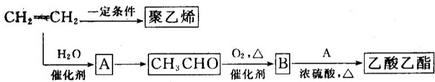
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取6根铁钉,6支干净的试管及其他材料,如图所示.
取6根铁钉,6支干净的试管及其他材料,如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com