
A、混合液中:c(H+)≤
| ||
| B、混合液中:c(HA)+c(A-)=amol?L-1 | ||
| C、a=b | ||
| D、混合液中:c(H+)+c(B+)=c(OH-)+c(A-) |
| KW |


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
| A、NH4HSO3溶于过量的NaOH溶液中:HSO3-+OH-=SO32-+H2O |
| B、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| C、Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| D、酸性KMnO4溶液与双氧水溶液反应:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
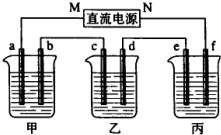 如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:
如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序:①=②>③ |
| B、相同条件下pH=5的①NH4Cl溶液 ②CH3COOH溶液 ③稀盐酸溶液中由水电离的c(H+):①>②>③ |
| C、常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度大小顺序为:c(HB)>c(Na+)>c(B-)>c(H+)>c(OH-) |
| D、常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量氯气和溴化亚铁溶液反应:C12+2Br-=2Cl-+Br2 |
| B、氢氧化钡溶液中加入少量的硫酸氢钠溶液:Ba2++H++OH-+SO42-=BaSO4↓+H2O |
| C、蛋壳溶于食醋中:CaCO3+2H+=Ca2++CO2↑+H2O |
| D、金属钠投入硫酸铜溶液中:2Na+Cu2+=Cu+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 环境 |  |
 |
 |
 |
| 行为 | 切勿随意进入 | 严禁烟火 | 尽量远离 | 顺风向低处跑 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的SO2通人NaOH溶液中:SO2+2OH-=SO32-+H2O |
| B、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| C、碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D、少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com