
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
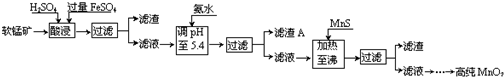
分析 软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后的滤液中的金属阳离子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由离子开始沉淀及沉淀完全的pH可知,调节pH为5.4,将Fe3+、Al3+沉淀,加入硫化锰将Cu2+、Zn2+沉淀,滤液为硫酸锰溶液,再通过系列变化得到高纯度的二氧化锰,
(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,则Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成;
(2)调节溶液的pH值要用到pH计或精密pH试纸进行测量,由题目信息可知,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH进行判断;
(3)根据工艺流程及硫化物的Ksp判断;
(4)由碱性锌锰干电池的电池反应式可知,Zn作负极,MnO2得电子作正极,生成MnOOH,由电荷守恒可知还生成OH-,由元素守恒可知,还有水参与反应;
(5)从碱性锌锰干电池的原料判断;
(6)根据K=$\frac{c(Fe{\;}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(Fe{\;}^{3+}){c}^{3}(O{H}^{-})}{{c}^{3}({H}^{+}){c}^{3}(O{H}^{-})}$=$\frac{K{\;}_{sp[Fe(OH){\;}_{3}]}}{{K}_{w}}$计算;
解答 解:(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)调节溶液的pH值要用到pH计或精密pH试纸进行测量,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水调pH至5.4,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣A的主要成分为
Fe(OH)3和Al(OH)3,
故答案为:pH计或精密pH试纸;Fe(OH)3和Al(OH)3;
(3)根据题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,
故答案为:Cu2+、Zn2+;
(4)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子,其电极反应式应为MnO2+H2O+e-=MnOOH+OH-,
故答案为:MnO2+H2O+e-=MnOOH+OH-;
(5)从碱性锌锰干电池的原料可知,其废旧电池可回收利用的物质为锌和MnO2,
故答案为:锌、二氧化锰;
(6)由离子方程式可知,K=$\frac{c(Fe{\;}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(Fe{\;}^{3+}){c}^{3}(O{H}^{-})}{{c}^{3}({H}^{+}){c}^{3}(O{H}^{-})}$=$\frac{K{\;}_{sp[Fe(OH){\;}_{3}]}}{{K}_{w}}$=$\frac{2.79×10{\;}^{-39}}{(1×1{0}^{-14})^{3}}$=2.79×103,
故答案为:2.79×103.
点评 考查学生对元素及其化合物的主要性质的掌握、书写电极反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.


科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| B. | 加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 | |
| C. | 加热时,c中溶液红色变深,冷却后又变浅 | |
| D. | ④左侧为e右侧为f,在惰性电极e和f附近分别滴加紫色石蕊试液,e电极附近呈红色,f电极附近呈蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、Cu、Ag、Al、Mg | B. | Mg、Cu、Al、Ag、Fe | C. | Al、Cu、Ag、Mg、Fe | D. | Mg、Ag、Cu、Al、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图1装置测定中和热的实验步骤如下:
利用如图1装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | 温度差平均值(t2-t1)℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )
),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )| A. | 68 | B. | 75 | C. | 80 | D. | 87.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳 | B. | 乙醇(C2H5OH) | C. | 甲酸(HCOOH) | D. | 甲醇(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com