
下列各溶液的叙述中不正确的是(???? )
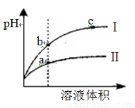
A.等pH的硫酸与醋酸稀释后pH的变化如图所示,则曲线Ⅱ表示的是醋酸的稀释图像
B.溶有等物质的量的NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
C.若NH4HCO3溶液、NH4HSO4溶液中c(NH4+)相等,则: c(NH4HSO4)<c(NH4HCO3)
D.已知某温度下Ksp(CH3COOAg) = 2.8×10-3,浓度均为0.1 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀
D
【解析】
试题分析:醋酸是弱酸,边稀释边电离,溶液的PH值上升较缓慢,而硫酸是强酸,稀释时溶液PH上升较快,故比较可以得出曲线II是醋酸的稀释图像,A正确;NaClO和NaHCO3等物质的量关系,所以在溶液中有物料守恒c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),B正确;NH4HCO3溶液发生较弱的双水解,而NH4HSO4是强酸酸式盐,水解受抑制,所以NH4HCO3溶液、NH4HSO4溶液等浓度时,前者溶液中的NH4+要小些,若c(NH4+)相等,则必然有c(NH4HSO4)<c(NH4HCO3),故C正确;浓度均为0.1 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合后体积变为原来的2倍,初始浓度变为原来的的一半0.05mol/L,因此在计算浓度商为2.5×10-3 < 2.8×10-3 ,所以一定不能产生CH3COOAg沉淀,D错误;故选D。
考点:本题考查的是强酸、弱酸的稀释、混合溶液中离子浓度大小比较、浓度商判断是否有沉淀析出等知识。


科目:高中化学 来源:不详 题型:单选题
| A.25℃时,将20 mL 0.1mol?L-1H2SO4溶液和30mL 0.15mol?L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11 |
| B.常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液 ②pH=3的HCl溶液 ③pH=11的氨水中由水电离出的c(H+):①>③>② |
| C.常温下,0.1 mol/L HA(某酸)溶液pH≠l,则BA(盐)溶液pH一定大于7 |
| D.25℃时,pH相同的溶液①CH3COONa ②C6H5ONa ③NaHCO3中c(Na+):①>③>② |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省成都市双流县棠湖中学外语实验学校高三(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com