
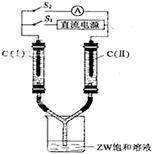
 2NaOH+H2↑+Cl2↑(2分,条件未写扣1分,未配平扣1分),
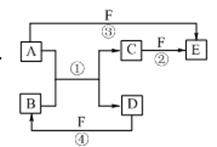
2NaOH+H2↑+Cl2↑(2分,条件未写扣1分,未配平扣1分), 2NaOH+H2↑+Cl2↑,C(Ⅰ)附近溶液变红,这说明C(Ⅰ)是阴极,生成氢气。断开S1,接通S2,电流表的指针发生偏转,说明此时构成原电池。由于氢气在反应中失去电子,所以C(Ⅰ)电极是负极,C(II)电极是正极,氯气得到电子,其电极反应式是Cl2+2e-=2Cl-。
2NaOH+H2↑+Cl2↑,C(Ⅰ)附近溶液变红,这说明C(Ⅰ)是阴极,生成氢气。断开S1,接通S2,电流表的指针发生偏转,说明此时构成原电池。由于氢气在反应中失去电子,所以C(Ⅰ)电极是负极,C(II)电极是正极,氯气得到电子,其电极反应式是Cl2+2e-=2Cl-。

 53天天练系列答案
53天天练系列答案科目:高中化学 来源:不详 题型:填空题
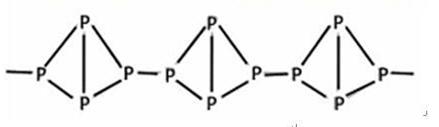 ,
,| A.它在空气中完全燃烧的产物是P2O5 | B.它不溶于水 |
| C.它在常温下呈固态 | D.它与白磷互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
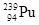 是钚的一种具有放射性的核素,下列关于
是钚的一种具有放射性的核素,下列关于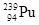 的说法中正确的是( )
的说法中正确的是( )| A.质量数是239 | B.核外电子数239 |
| C.质子数是145 | D.中子数是94 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
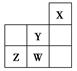
| A.W的最高价氧化物对应的水化物是强酸 |
| B.Y的原子半径在同周期主族元素中最大 |
| C.W的非金属性比Z的弱 |
| D.Z的气态氢化物的稳定性在同主族元素中最强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
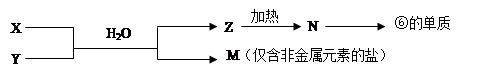
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
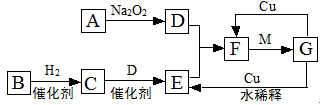
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com