
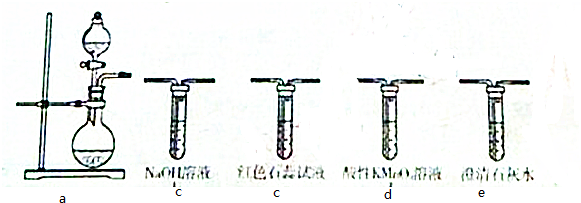
分析 (1)配成250mL溶液A溶液步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,根据配制步骤选择使用的仪器;
(2)根据用1.000 mol•L-1 KI标准溶液滴定锥形瓶中的Fe3+,消耗KI标准溶液24.00mL,计算出铁的物质的量,在转化成250mL溶液中铁的物质的量,结合样品22.8g计算氧的物质的量,根据铁与氧的原子个数之比确定化学式;
(3)取剩余溶液A,加入足量铁粉并加热将三价铁还原成二价铁,充分反应趁热过滤减少过滤时硫酸亚铁析出而损失;
(4)加热浓缩滤液B,冷却结晶、过滤、洗涤、干燥,获得FeSO4•7H2O晶体;
(5)根据双氧水易分解生成氧气分析;
(6)根据CO2、SO2能使澄清石灰水变浑浊判断.
解答 解:(1)配成250mL溶液A过程中使用的仪器有:托盘天平、药匙、烧杯、玻璃棒、量筒、100mL容量瓶、胶头滴管,所以必须使用的玻璃仪器为烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管,故答案为:250mL容量瓶;
(2)取20.00mL溶液A,于锥形瓶中,滴加KSCN试液,溶液变红;继续滴加双氧水至过量,溶液红色褪去,同时有气泡产生,待气泡消失后,用1.000 mol•L-1 KI标准溶液滴定锥形瓶中的Fe3+,消耗KI标准溶液24.00mL,由反应2Fe3++2I-═2Fe2++I2,则20.00mL溶液A中铁的物质的量为:1.000 mol•L-1×0.024mL=0.024mol,所以
250mL溶液中铁的物质的量为=$\frac{0.024mol}{20}$×250=0.3mol,又样品22.8g,所以氧的物质的量为$\frac{22.8-0.3×56}{16}$=0.375mol,则n(Fe):n(O)=0.3:0.375=4:5,该氧化物的化学式是Fe4O5,故答案为:Fe4O5;
(3)取剩余溶液A,加入足量铁粉并加热将三价铁还原成二价铁,充分反应趁热过滤减少过滤时硫酸亚铁析出而损失;
故答案为:减少过滤时硫酸亚铁析出而损失;
(4)加热浓缩滤液B,冷却结晶、过滤、洗涤、干燥,获得FeSO4•7H2O晶体,故答案为:过滤、干燥;
(5)因为双氧水易分解生成氧气,所以气泡还可能有O2,反应方程式为:2H2O2═2H2O+O2↑,故答案为:O2;2H2O2═2H2O+O2↑;
(6)因为CO2、SO2都能使澄清石灰水变浑浊,所以a→e,观察到e中变浑浊,但不能证明是CO2还是SO2还是CO2、SO2的混合气体,故答案为:e,e中变浑浊,不能证明是CO2还是SO2还是CO2、SO2的混合气体.
点评 本题考查化学式的测定以及物质的制备,为高频考点,把握实验的步骤及其目的为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 该温度下,Ksp (BaSO4 )=1.0×10-24 | |
| B. | a点的Ksp (BaSO4 )小于b点的Ksp (BaSO4 ) | |
| C. | d点表示的是该温度下BaSO4的不饱和溶液 | |
| D. | 加入BaCl2可以使溶液由 c点变到a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IIA族中无非金属元素 | B. | 第IA族金属元素单质均能与水反应 | ||
| C. | 元素种类最多的族是第VIII族 | D. | 金属元素的种类比非金属元素多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的燃烧热为1256 kJ•mol-1 | |
| B. | 若生成2 mol液态水,则△H=-2512 kJ•mol-1 | |
| C. | 若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ | |
| D. | 若转移10 mol电子,则消耗2.5 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ①③⑤ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
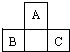 A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则
A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则 ,A的氢化物分子式为H2O;
,A的氢化物分子式为H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
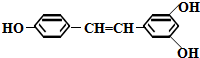 ,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )
,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )| A. | 13种 | B. | 15种 | C. | 17种 | D. | 19种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| ⑤ | 判断不同反应的反应速率的大小 | 比较不同反应的反应热数据的大小 |
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com