
【题目】下列化学反应的离子方程式正确的是 ( )
A.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=[Al(OH)]4-
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
科目:高中化学 来源: 题型:
【题目】如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的。将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,不会出现的现象是( )
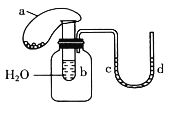
A.气球a变大
B.试管b内有气泡冒出
C.U形管内浅红色褪去
D.U形管水位d高于c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物 NaBH4(B元素的化合价为+3价)和 H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用 MnO 2,可用作空军通信卫星电源,其工作原理如图所示。 下列说法不正确的是

A. 电极a采用Pt/C,电极b采用 MnO2
B. 电池放电时 Na +从b极区移向a极区
C. 负极电极反应式为:BH4- +8OH- -8e-=BO2-+6H2O
D. 反应中每消耗3mo lH2O2,转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雄黄 (As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是_____,反应产生的气体可用____吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3- = 2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为____。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量_____(填字母)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mLcmol·L-1KOH溶液中滴加0.1mol·L-1HCOOH溶液,混合溶液中水电离的氢氧根离子浓度与滴加甲酸(弱酸)溶液体积(V)的关系如图所示。下列说法正确的是
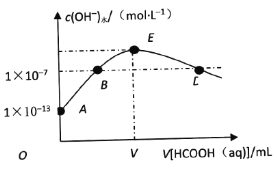
A. 上述KOH溶液的浓度c=0.01mol·L-1
B. B点对应的溶液中:c(K+)=c(HCOO-)
C. E点对应的溶液中:c(OH-)>c(H+)=c(HCOOH)
D. 若D点对应的甲酸溶液体积为V1mL,则HCOOH电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知:δ(X)=![]() ]。下列叙述错误的是
]。下列叙述错误的是

A. K1(H2A)=10-1.2
B. pH=2.7时,c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1
C. pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D. pH=4.2时,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、Cu2+、CO32—、SO42—、NO3—中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法错误的是
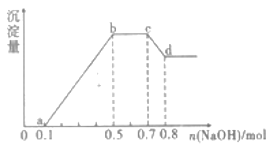
A. 溶液中的阳离子有H+、Mg2+、Al3+、NH4+
B. cd段的离子方程式为Al(OH)3+OH—=AlO2—+2H2O
C. 溶液中n(NH4+)=0.2mol
D. n(H+):n(Mg2+):n(Al3+)=1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4溶液和CuS混合时,发生的反应如下:MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O,下列有关该反应的说法中正确的是( )
A.被氧化的元素是Cu和S
B.![]() 的还原性强于CuS的还原性
的还原性强于CuS的还原性
C.氧化剂与还原剂的物质的量之比为6:5
D.若生成2.24LSO2,转移电子的物质的量是6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式________。
(2)根据等电子原理,写出CO分子的结构式______。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________;甲醛分子中碳原子轨道的杂化类型为________。
②甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com