
����Ŀ����ͼ����MgCl2��AlCl3�����Һ������ʼ�μ�7 mL�Լ�A��֮��ĵμ��Լ�B�����ó������ʵ���y (mol) ���Լ����V(mL)��Ĺ�ϵ��ͼ��ʾ��(�Լ�A��B�ֱ���NaOH ��Һ�����е�һ��)
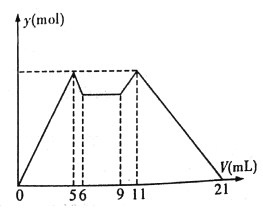
���½��۲���ȷ����
A. A��NaOH ��Һ��B������
B. ԭ���Һ����c(Al3+) :c(Mg2+) :c(Cl-)=1:1:5
C. c(NaOH) :c(HCl)=1:2
D. ��6 ��9 �Ĺ������������ķ�Ӧ�����ӷ�Ӧ����ʽ��H+ +OH-=H2O
���𰸡�C
������������ͼ��֪��MgCl2��AlCl3�����Һ�У���ʼ�μ�7mL�Լ�A������A��������������NaOH��MgCl2��AlCl3��Ӧ���ɳ�����HCl����Ӧ������A��NaOH��B��HCl��5mL��11mLʱ���������������ȣ�ΪAl(OH)3��Mg(OH)2�������������ֳ�������5mLNaOH��������ȫ�ܽ�����10mLHCl���൱����Ӧ�������1��1��Ӧ���������֮��Ϊ1��2����c(NaOH)��c(HCl)=2��1��5-6mLʱ��NaOH�ܽ�������������������1mL������������������������NaOH���Ӧ����3mL��0-5mLΪ����Al(OH)3��Mg(OH)2����������2mLΪ����Mg(OH)2����ʱ���ĵ�����������Һ����������Al(OH)3��Mg(OH)2��������NaOH����ֱ���3mL��2mL�����ݹ�ϵʽ֪��c(Al3+)��c(Mg2+)=1��1��A.��������������A��NaOH��Һ��B�����ᣬ��A��ȷ��B���Ӽ���5 mL A���ɳ�����࣬�ټ�����1 mL A���������ٵ���Сֵ����Ӧ��Ӧ�����ӷ���ʽΪ��Al(OH)3+OH-=AlO2-+2H2O���ɴ˿�֪��n(Al3+)=n��Al(OH)3��=(1��6��10-3) mol����ǰ5 mL NaOH�γ�����������֪��2n(Mg2+)+3n(Al3+)=(5��10-3��6)mol������n(Mg2+)=(1��6��10-3) mol����Һ�������������������ȵã�n(Cl-)=(5��10-3��6)mol������Һ��c(Mg2+)��c(Al3+)��c(Cl-)=1��1��5����B��ȷ��C�����ݼ���ǰ6 mL�Լ�ʱ�����г������ɶ����ܽ⣬���ԣ��Լ�A��NaOH����B�����ᣬ����ͼ��֪��0��5(5 mL)��11��21(10mL)�ֱ��ǵõ�Al(OH)3��Mg(OH)2�����ͳ����ܽ⣬���������൱����Ӧ�������1��1��Ӧ���������֮��Ϊ1��2����c(NaOH)��c(HCl)=2��1����C����D����6mL��9mL��ӦҺ���г�������ȣ�������֪��ʱ������������кͷ�Ӧ����H++OH-=H2O����D��ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����2L�����ܱ���������̬����X��Y��Z�����ʵ�����ʱ��仯�IJ������������ʾ��
T/min | n��X��/mol | n��Y��/mol | n��Z��/mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
��1��д���÷�Ӧ�Ļ�ѧ����ʽ
��2����Ӧ���е�10min��X��ת����Ϊ �� 0��5min��Y��ƽ����Ӧ����Ϊ
��3������T��ʱ�÷�Ӧ��ƽ�ⳣ��K=
��4��T��������ܱ�������ͨ��һ������X��Y��Z����Ӧ��ijʱ�̲��X��Y��Z�����ʵ����ֱ�Ϊ1.00mol��0.50mol��1.60mol�����ʱ���淴Ӧ���ʴ�С��v��v��������ڡ��������ڡ�����С�ڡ���
��5������10min��t3��t5ʱ�̷ֱ�ı�÷�Ӧ��ijһ��Ӧ�������õ�X��Z�����ʵ�������Ӧ������ʱ��Ĺ�ϵ��ͼA��B��ʾ�� 
��10minʱ�ı�ķ�Ӧ������
��t3ʱ�̸ı�ķ�Ӧ������t5ʱ�̸ı�ķ�Ӧ������ �� ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.���ӻ�������һ�����н���Ԫ��B.ԭ�Ӿ����ۻ�Ҫ�ƻ����ۼ�
C.���ɷ��Ӿ��������һ�����й��ۼ�D.ֻ�����ӻ������вŴ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������Һ�л����ܴ���Al3+��Fe2+��NH4+��Ba2+��Cl-��CO32-��SO42-��NO3-�е�����������ȡ������Һ��������һϵ��ʵ��(��֪��������������Ի����о���ǿ����������ԭ����һ��Ϊ����)

�����й��ж���ȷ����
A. ��Һ��һ����Fe2+��SO42-��H+��NH4+��Al3+
B. ��Һ��һ��û��Ba2+��CO32-��NO3-
C. �������з�����Ӧ�����ӷ���ʽΪ:2AlO2-+CO2+3H2O=2Al(OH)3��+CO32-
D. ����B�ڿ����л�Ѹ�ٱ�Ϊ����ɫ,����Ϊ���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ǣ� ��
A.�ý����ƿ������Ҵ�������
B.�ø������������Һ�����ּ����3����ϩ
C.��ˮ�����ֱ����屽
D.��������Ȼ�̼��Һ��������ϩ����Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ̬���пɵ������������NH2����NH4+������˵����ȷ����
A.NH3�������ӻ�����B.�����£�Һ���ĵ���ƽ�ⳣ��Ϊ10��14
C.Һ̬���백ˮ�������ͬD.Һ���е�������ͬ�ĵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ������һ��ԭ����CH3OH��g����H2O��g����Ӧ����CO2��H2 �� ͼ�Ǹù����������仯ʾ��ͼ�����ڷ�Ӧ��ϵ�м����������Ӧ������������Ӧ��� a�ı仯�������������С���������䡱������Ӧ�ȡ�H�ı� ���������������С���������䡱������д����Ӧ����CH3OH��g����H2O��g����Ӧ���Ȼ�ѧ����ʽ �� 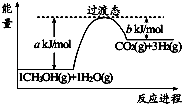
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I�ĺϳ�·�����£� 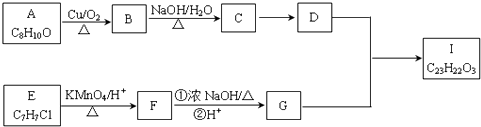
��֪������Ϣ��
��A��I��Ϊ�����廯���B������ֻ��һ��ȡ������B��������Ӧ��D����Է�������
��C��4��E�ĺ˴Ź���������3��壮
�� ![]()
�� ![]()
��ش��������⣺
��1��A��B�ķ�Ӧ����Ϊ �� D���������ŵ�����Ϊ �� E������Ϊ
��2��E��F��F��G��˳���ܷ�ߵ�����ܡ��������� ��
��3��B��������Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��4��I�Ľṹ��ʽΪ ��
��5����������Ҫ��A��ͬ���칹�廹���֣�
����Na��Ӧ������H2 �ڷ����廯����
��6��������֪ʶ����������Ϣ��д����CH3CH2OHΪԭ���Ʊ�CH3CH2CH2CH2OH�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��A��B��C��ʵ���ҳ��õ�������ȡ�����װ�ã��ṩ��ҩƷ�У�����ʯ��Ũ���ᡢп����ϡ���ᡢ�������̡��Ȼ�李���ʯ�ң�����������ЩҩƷ�ֱ���ȡNH3��Cl2��H2��CO2�������壬�Իش��������⣺
��1��ѡ��Aװ�ÿ���ȡ����������ѡ��Bװ�ÿ���ȡ����������ͨ��ѡ��Cװ����ȡ�������� ��
��2�����Ϊ�١��ڵ����������������� ��
��3��д�����������й�ҩƷ��ȡCl2�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com