
 如图是某中学实验室的一瓶硫酸试剂标签上的部分内容.
如图是某中学实验室的一瓶硫酸试剂标签上的部分内容.| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |
| 1.0mol/L×0.1L |
| 18.4mol/L |


科目:高中化学 来源: 题型:
| A、一定存在HCl |
| B、一定存在SO2 |
| C、肯定没有CO2 |
| D、不能肯定是否含有HI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH3 |
| B、CH2=CHCH=CH2 |
| C、CH3CH2CH2OH |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池.氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料.请回答下列问题:
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池.氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
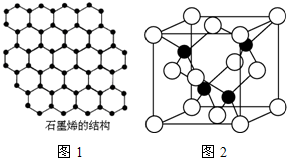
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
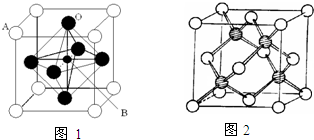 过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验需要用1.0mol?L-1 NaOH 溶液500mL.
某实验需要用1.0mol?L-1 NaOH 溶液500mL.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水 |
| B、用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶 |
| C、在钠跟水反应的实验中,切下绿豆粒大小的钠投入水中进行实验,剩余的钠块丢弃到废料桶中 |
| D、若FeCl2溶液中含有I-杂质,可用过量Cl2氧化后进行萃取分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com