
| 试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
| 褪色时间 | 28秒 | 30秒 | 不褪色 |
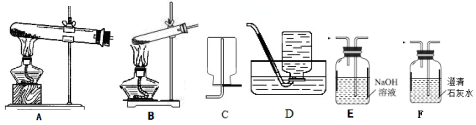
分析 (1)用下列装置分解草酸制备少量纯净的CO,草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,据此选择;
(2)酸性溶液中高锰酸钾溶液氧化草酸生成二氧化碳;相同条件下增大高锰酸钾溶液浓度,反应速率增大;
(3)证明草酸为弱酸需要证明溶液中存在电离平衡,弱酸形成的强碱弱酸盐是否水解或者与等浓度的强酸酸性强弱比较分析;
(4)①强碱滴定弱酸到反应终点生成草酸钠,生成的为强碱弱酸盐显碱性,所以选择酚酞作指示剂;
②H2C2O4+2NaOH=Na2C2O4+2H2O,结合化学反应定量关系计算;
③滴定操作误差分析可以把失误归结为消耗滴定管中溶液体积的变化分析判断一下结果,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$;
解答 解:(1)拟用下列装置分解草酸制备少量纯净的CO,草酸晶体分解生成二氧化碳、一氧化碳、水,利用发生装置B分解晶体,气体通过装置E吸收二氧化碳,利用排水法收集一氧化碳,其合理的连接顺序为B-E-D,
故答案为:B-E-D;
(2)酸性溶液中高锰酸钾溶液氧化草酸生成二氧化碳,反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8 H2O,硫酸、草酸浓度相同,改变高锰酸钾溶液浓度分析反应速率变化,高锰酸钾溶液浓度越大,反应速率越快,实验中KMnO4的浓度cB>cA,且其反应速率νB>νA,上述实验能说明相同条件下,反应物浓度越大,反应速率越快,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8 H2O;能;实验中KMnO4的浓度cB>cA,且其反应速率νB>νA;
(3)A.草酸为二元酸,若为强酸电离出氢离子浓度为0.02mol/L,PH小于2,室温下,取0.010mol/L的H2C2O4溶液,测其pH=2,说明存在电离平衡,证明酸味弱酸,故A正确;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH>7,说明HC2O4-离子水解溶液显碱性,证明草酸氢根离子为弱酸阴离子,但不能证明草酸为弱酸,故B错误;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH<a+2,说明稀释促进电离,溶液中存在电离平衡,为弱酸,故C正确;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL,强酸和弱酸都符合,和强酸弱酸无关,故D错误;
故答案为:AC;
(4)①强碱滴定弱酸到反应终点生成草酸钠,生成的为强碱弱酸盐显碱性,所以选择酚酞作指示剂,滴入最后一滴锥形瓶内溶液由无色变成(粉)红色,且半分钟内不变化,
故答案为:酚酞;锥形瓶内溶液由无色变成(粉)红色,且半分钟内不变化;
②取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL,其中22.02mL误差太大,消耗平均体积=$\frac{19.98ml+20.02ml}{2}$=20ml,
H2C2O4+2NaOH=Na2C2O4+2H2O,
1 2
0.020L×c 0.1000mol/L×0.020l
c=0.05000mol/L,
故答案为:0.05000mol/L;
③滴定操作误差分析可以把失误归结为消耗滴定管中溶液体积的变化分析判断一下结果,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,
A.滴定管在盛装NaOH溶液前未润洗,导致溶液浓度减小,消耗标准溶液体积增大,测定结果偏高,故A正确;
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出,待测液减小,消耗标准溶液体积减小,测定结果偏低,故B错误;
C.滴定前读数正确,滴定终点时俯视读数,读取的标准溶液体积减小,测定标准溶液难度偏低,故C错误;
D.滴定前读数正确,滴定终点时仰视读数,读取标准溶液体积增大,测定结果偏高,故D正确;
故答案为:A D.
点评 本题考查了物质分解产物的分析判断、实验验证方法、弱电解质的电离平衡、滴定实验的步骤、过程、反应终点判断方法和计算等,掌握基础是解题关键,题目难度中等.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 若产物为NaClO、NaCl,则吸收后的溶液中n(ClO-)═n(Cl-) | |
| B. | 若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1:5 | |
| C. | 若产物为NaClO、NaClO3、NaCl,则由吸收后溶液中n(Cl-)和n(ClO3-)可计算吸收的n(Cl2) | |
| D. | 若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比一定为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气、液氯和氯水是同一种物质 | |
| B. | Na2O、Na2O2组成元素相同,与CO2都能发生氧化还原反应 | |
| C. | 硫酸钡难溶于水,但硫酸钡是电解质 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r (W)>r (Z)>r (Y)>r (X) | |
| B. | 最高价氧化物对应的水化物的碱性:Y>Z | |
| C. | X、W的简单气态氢化物都易溶于水 | |
| D. | Z的最高价氧化物对应的水化物一定能溶于X的最高价氧化物对应的水化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8Cl2有9种同分异构体 | |
| B. | 糖类、油脂、蛋白质均能发生水解反应 | |
| C. | 通过乙烯的取代反应可制得氯乙烷 | |
| D. | 乙醇、乙酸均能与NaOH 溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量稀硫酸与少量锌反应,滴加少量 CuSO4 溶液,加快了反应速率,不影响 H2总量 | |
| B. | 足量的锌和少量稀硫酸反应,加入醋酸钠溶液降低反应速率,减少了生成的 H2总量 | |
| C. | 2-甲基丙烷光照下与氯气反应,得到 3 种一氯代物 | |
| D. | 仅用水就能鉴别酒精和己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同状况下两电极上产生的气体体积之比为2:1 | |
| B. | 两电极上产生的气体质量之比为8:1 | |
| C. | 相同状况下两电极上产生的气体体积之比为4:1 | |
| D. | 若两电极上产生的气体质量比为16:3,则D2O与H2O的物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com