
【题目】恒容密闭容器中发生反应C(s)+H2O(g)![]() CO(g)+H2(g),下列状态中不能表明该反应达到平衡状态的是( )
CO(g)+H2(g),下列状态中不能表明该反应达到平衡状态的是( )
A.断裂氢氧键速率是断裂氢氢键速率的2倍
B.混合气体平均相对分子质量不再改变
C.单位时间内消耗水与生成氢气的质量比为9∶1
D.混合气体的物质的量不再发生变化
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
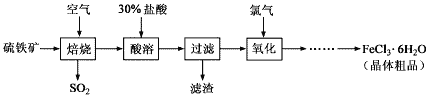
(1)回答下列问题:在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)![]() 2SO3(g),该反应的平衡常数表达式为K=______;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,请解释亚硫酸氢钠溶液呈酸性的原因____。
2SO3(g),该反应的平衡常数表达式为K=______;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,请解释亚硫酸氢钠溶液呈酸性的原因____。
(2)酸溶及后续过程中均需保持盐酸过量,其目的分别是____、_____。
(3)加热FeCl3·6H2O晶体,得到无水FeCl3需在干燥的HCl气流中进行,否则得到的产物为____。
(4)自来水厂同时用氯气和绿矾(FeSO4·7H2O)进行消毒、净化水,其原理是(用离子方程式表示)___________,__________,和Fe3++3H2O![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式________。
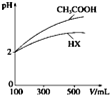
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)。
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中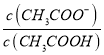 =____________。
=____________。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.环戊二烯(![]() )分子中所有原子共平面
)分子中所有原子共平面
B.同主族元素含氧酸的酸性随核电荷数的增加而减弱
C.二甲醚易溶于水,氨基乙酸的熔点较高,主要原因都与氢键有关
D.NO![]() 离子中心原子上的孤电子对数是0,立体构型为平面三角形
离子中心原子上的孤电子对数是0,立体构型为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院深圳研究院成功研发出一种基于二硫化钼/碳纳米复合材料的钠型双离子电池,可充放电。其放电时工作原理如图所示。下列说法不正确的是( )
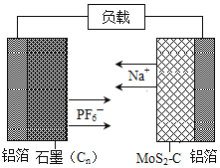
A.二硫化钼/碳纳米复合材料为该电池的负极材料
B.放电时正极的反应式为Cn(PF6)x+xe-═xPF6-+Cn
C.充电时阴极的电极反应式为MoS2-C+xNa++xe-=NaxMoS2-C
D.充电时石墨端铝箔连接外接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗高磷酸盐血症。某化学小组用如图装置模拟制备碳酸镧,反应为2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O,下列说法正确的是( )
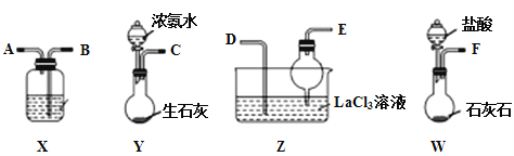
A.从左向右接口的连接顺序:F→B,A→D,E←C
B.装置X中盛放的试剂为饱和Na2CO3溶液
C.装置Z中用干燥管的主要目的是增大接触面积,加快气体溶解
D.实验开始时应先打开Y中分液漏斗的旋转活塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
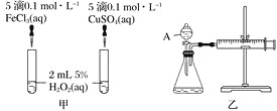
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
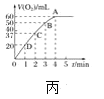
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
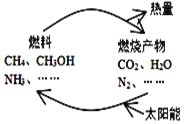
(1)在图构想的物质和能量循环中太阳能最终转化为______能;
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH(甲醇),该反应的化学方程式为:2CO2(g)+4H2O(g) ![]() 2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是____________(填序号);
2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是____________(填序号);
A.v正(H2O)=2v逆(CO2) B.n(CH3OH)∶n(O2)=2∶3
C.容器内压强保持不变 D.容器内混合气体密度保持不变
(3)①用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的______极(填“正”或“负”),通入氧气一极的电极反应式:_________。
②若用氢氧化钾溶液作电解液制成甲醇燃料电池,其负极的电极反应式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com