
有些化学实验操作的“先”与“后”,对化学实验结果或安全具有十分重要的意义。下列对实验操作“先”与“后”的设计中,正确的是( )。
A.制备气体前,先往装置中装入药品,后检查装置的气密性
B.稀释浓硫酸时,先往容器中装水,后慢慢倒入浓硫酸并不断搅拌
C.测定溶液的酸碱度时,先将pH试纸用水润湿,后沾上被测溶液
D.做一氧化碳还原氧化铁的实验时,先加热、后通一氧化碳
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是__________________________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是____________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO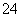 )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;X的制备过程中温度不能过高的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.熵变小于零而焓变大于零的反应肯定不能发生
B.热化学方程式中ΔH的值与反应物的用量有关
C.化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,
但反应前后物质的总能量不变
D.用蒸馏水稀释0.1mol/L的醋酸至0.01mol/L,稀释过程中温度维持25℃不变,溶
液中各离子浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用来消
毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,欲准确测定过氧化
氢的含量。请填写下列空白:
(1)取10.00 mL密度为ρg/mL的过氧化氢溶液稀释至250mL。移取稀释后的过氧化
氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为 。
(3)滴定时,将高锰酸钾标准溶液注入 (填“酸式”或“碱式”)滴定管
中,滴定到达终点的现象是 。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中
过氧化氢的质量分数为 。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 (填
“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中错误的是( )。
A.进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
B.进行萃取操作时,应选择有机萃取剂
C.进行蒸发操作时,蒸干至当出现大量固体时,应停止加热用余热蒸干
D.进行分液操作时,分液漏斗中下层液体从下口放出后,换一洁净烧杯继续接取上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案合理的是
A.配制50g质量分数为5%NaCl溶液:将45mL水加入到盛有5g NaCl的烧杯中,搅拌溶解
B.制备乙酸乙酯:用如图所示的实验装置

C.鉴定SO42—:向溶液中加入盐酸酸化的氯化钡溶液
D.鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法在一定条件下可以实现的是
①酸性氧化物与碱发生反应 ②弱酸与盐溶液反应可生成强酸 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应 ⑥两种含氧化合物反应的产物有气体
A.①②③④⑤⑥ B.②④⑤⑥
C.①②③⑤ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:
|
| 相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫 酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 oC。
酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 oC。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5% 碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
(1)装置b的名称是_______________
(2)加入碎瓷片的作用是____________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是____________(填正确答案标号)。
A.立即补加 B. 冷却后补加 C. 不需初加 D. 重新配料
(3)本实验中最容易产生的副产物的结构简式为_________________。
(4)分液漏斗在使用前必须清洗干净并________。在本实验分离过程中,产物应该从分液漏斗的__________(填“上口倒出”或“下口倒出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_________________。
(6)在环已烯粗产物蒸馏过程中,不可能用到的仪器有_________(填正确答案标号)。
A.圆底烧瓶 B. 温度计 C. 吸滤瓶 D. 环形冷凝管 E. 接收器
(7)本实验所得到的环己烯产率是_________(填正确答案标号)。
A. 41% B. 50% C. 61% D. 70%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com