
【题目】某同学类比镁在二氧化碳中的燃烧反应,认为钠和二氧化碳也可以发生反应,他在实验室中选择以下装置对该反应能否发生进行了实验探究。

依据要求回答问题:
(1)二氧化碳的发生装置应选用上述装置中的______(填装置下方对应宇母),反应的化学方程式为________________。
(2)为达到实脸目的,选择上图中的装置,其连接顺序为:二氧化碳的发生装置→_____________。(按气流方向,用小写字母表示)。
(3)检查装置气密性良好,装好药品后,打开弹簧夹,待装置中的空气排净后才能点燃酒精灯。能说明装置中空气已经排净的现象是_____________。
(4)该同学在制取CO2的过程中,向装置B中加入某酸后,发现固体与酸没有接触,为使反应顺利进行,下列可再加入的试剂是_____________。
A.稀硝酸 B.H2SO4溶液 C.苯 D. CCl4
(5)若反应过程中CO2足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为Na2CO3 ② 生成的固体物质为Na2CO3和C的混合物 ③生成的固体物质为Na2CO3和Na2O的混合物 ④生成的固体物质为Na2O和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是________;则钠与CO2反应的化学方程式为____________。
(6)该同学经过反思,认为上述实验设计中存在缺陷。他查阅资料后得知,PdCl2溶液可以吸收CO,同时得到黑色的Pd。于是他在装置后加装一个盛PdCl2溶液的吸收装置,该装置中发生反应的化学方程式为____________。
【答案】 B CaCO3+2HCl=CaCl2 + CO2↑+H2O f→g→d→e→a(b)→b(a)→h→i E中石灰水变浑浊 AD 在该实验条件下,二氧化碳与单质炭及氧化钠可以发生反应 2Na+2CO2![]() Na2CO3+CO CO +PdCl2+ H2O =Pd↓+ CO2+2HCl
Na2CO3+CO CO +PdCl2+ H2O =Pd↓+ CO2+2HCl
【解析】(1)实验室通常利用碳酸钙和稀盐酸反应制二氧化碳,反应不需要加热,则可选择B装置来制备CO2,反应的化学方程式为CaCO3+2HCl=CaCl2 + CO2↑+H2O;
(2)制得的CO2中混有少量挥发的HCl气体,需要用饱和NaHCO3溶液除去,然后再用浓硫酸干燥,再通过A装置与Na反应,最后用澄清石灰水检验或除去尾气中的CO2,特别注意气体经过溶液时导管插入溶液中,排气管只能略微露出橡皮塞,则装置的连接顺序为:二氧化碳的发生装置→f→g→d→e→a(b)→b(a)→h→i;
(3)E装置中澄清石灰水变浑浊,可知装置中的空气已排净,可点燃酒精灯进行后续实验操作;
(4)A.稀硝酸可代替盐酸与碳酸钙反应生成CO2,故A正确;B.碳酸钙和稀H2SO4溶液反应时生成微溶的硫酸钙覆盖在碳酸钙表面,阻止反应继续进行,故B错误; C.苯的密度比水小在上层,无法使盐酸与碳酸钙接触,故C错误;D. CCl4的密度比水大,在下层,可使盐酸与碳酸钙接触,故D正确;答案为AD;
(5)在加热条件下,过量的CO2均可与单质碳及氧化钠发生反应,故可排除②③④三种情况;则钠与CO2反应生成Na2CO3,此时Na为还原剂,CO2为氧化剂,还原产物为CO,此反应的化学方程式为2Na+2CO2![]() Na2CO3+CO;
Na2CO3+CO;
(6)PdCl2溶液可以吸收CO,生成黑色的Pd,PdCl2是氧化剂,则CO是还原剂,氧化产物为CO2,结合电子守恒和原子守恒可知,反应同时有HCl生成,发生反应的化学方程式为CO +PdCl2+ H2O =Pd↓+ CO2+2HCl。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.1000 mol·L-1 CH3COONa 溶液中逐滴加入 0.100 0 mol L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是
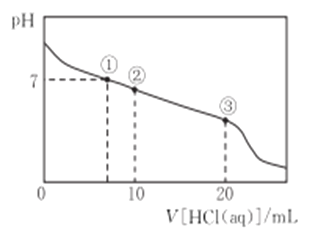
A. CH3COONa溶液中:c(H+) +c(CH3COOH)=c(OH-)+c(Na+)
B. 点①所示溶液中:c(CH3COOH) =c(Cl-)>c(OH-)=c(H+)
C. 点②所示溶液中:c(Cl-)>c(CH3COO-)>c(CH3COOH)>c(H+) >c(OH-)
D. 点③所示溶液中:c(Na+)= c(Cl-)>c(CH3COOH) >c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能如下:
化学键 | H—H | Cl—Cl | Cl—H |
键能/(kJ·mol-1) | 436 | 243 | 431 |
请计算H2(g)+Cl2(g) === 2HCl(g)的反应热
A. +862 kJ·mol-1 B. +679 kJ·mol-1 C. -183 kJ·mol-1 D. +183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)碳原子核外电子有_____种不同的运动状态。碳原子的价电子在形成sp3杂化后,其轨道表达式为_____。
(2)写出一种CO32-的等电子体微粒的化学式_______,其空问构型为_______。
(3)有机物M( )在一定条件下生成N(
)在一定条件下生成N( )。
)。
①沸点:M_____N (填“大于”或“小于”)。
②M中碳原子杂化类型为_____,不同杂化类型的碳原子数之比为_____。
③有机物N中除氢原子之外的其他原子的第一电离能由大到小的顺序为_____。
(4)已知CaCO3的热分解温度为900℃,SrCO3的热分解温度为1172℃,试从原子结构的角度解释CaCO3的热分解翻度低于SrCO3的原因_____________。
(5)石墨是碳的一种同素异形体,它的一种晶胞结构和部分晶胞参数如下图:

①原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为:A(0,0,0)、B(0,1,1/2)。则C原子的坐标参数为_______________。
②晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为am ,层间距为dcm,阿伏加德罗常数的值为NA,则石墨的密度为_____g·cm-3(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是
A. 容器内的总压强不随时间变化
B. 断裂4molH—O键的同时,断裂4molH—H键
C. 混合气体的平均相对分子质量不变
D. 反应不再进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件(温度、反应物用量等)改变,不会引起产物改变的是 ( )
A.Na2O2和CO2 B.NaOH和CO2 C.Na和O2 D.Na2CO3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物命名及其一氯代物的同分异构体数目正确的是( )
命名 | 一氯代物 | |
A | 2-甲基-2-乙基丙烷 | 4 |
B | 1,3-二甲基苯 | 3 |
C | 2,2,3-三甲基戊烷 | 6 |
D | 2,3-二甲基-4-乙基己烷 | 7 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com