
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:分析 A的产量通常衡量一个国家的石油化工水平,则A应为CH2=CH2,乙烯与水在一定条件下发生加成反应生成B为CH3CH2OH,乙醇在Cu或Ag作催化剂条件下发生氧化反应C为CH3CHO,CH3CHO可进一步氧化物D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成乙酸乙酯,以此解答该题.
解答 解:(1)B为乙醇,对应的同分异构体为,C为乙醛,含有的官能团为醛基,故答案为:CH3OCH3;醛基;
(2)B和D反应生成E的化学方程式为CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
点评 本题考查有机物推断、为高频考点,侧重考查学生的分析能力,注意把握烯与醇、醛、羧酸之间的转化关系等,难度不大,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
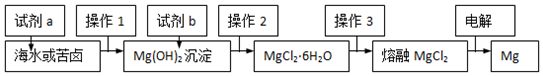
| A. | 流程中试剂a为NaOH溶液,试剂b为盐酸 | |
| B. | 操作2的具体方法是加热浓缩,冷却结晶 | |
| C. | 操作3是将晶体置于HCl气体氛围中脱水 | |
| D. | 电解MgCl2时,阳极生成Cl2,阴极生成Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
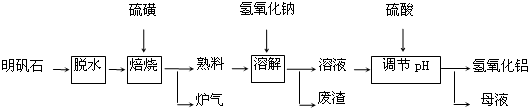
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 | B. | 0.333 | C. | 0.4 | D. | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者均有丁达尔效应 | B. | 两者均能透过半透膜 | ||
| C. | 分散质粒子可通过滤纸 | D. | 加入盐酸先沉淀,随后溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
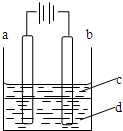 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀.若用如图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀.已知两极材料分别为石墨和铁:
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀.若用如图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀.已知两极材料分别为石墨和铁:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 小于0.2mol | ||
| C. | 大于0.2mol | D. | 大于0.2mol,小于0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取l.06g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中 | |
| B. | 定容时,若仰视,则所配溶液的浓度将偏高 | |
| C. | 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分 | |
| D. | 在使用容避瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸雕刻玻璃:Si+4HF═SiF4↑+2H2↑ | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com