
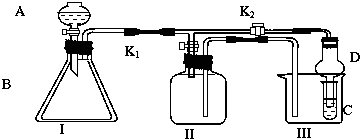
分析 (1)Ⅱ装置中进气管短,出气管长,为向下排空气法;NO与氧气反应;
(2)用排水法可以收集O2和NO等气体,二氧化氮与水反应,且易溶于水;
(3)比较H2SO4、H2CO3和H2SiO3的酸性强弱,可在Ⅰ中用碳酸钠和稀硫酸反应生成二氧化碳,Ⅲ为硅酸钠,与二氧化碳反应可生成硅酸沉淀;
(4)比较Ca(ClO)2>Cl2>Br2氧化性强弱,在Ⅰ中Ca(ClO)2与浓盐酸反应生成氯气,氯气与Ⅲ中NaBr溶液反应生成溴,溶液颜色由无色变为橙色或橙红色,注意防止氯气污染环境.
解答 解:(1)Ⅱ装置中进气管短,出气管长,为向下排空气法,O2、NO2的密度大于空气的密度,则O2、NO2应采用向上排空气法收集;一氧化氮和氧气能发生反应生成二氧化氮,一氧化氮应采用排水法收集,所以该装置不能收集氧气和一氧化氮,
故答案为:O2、NO2密度比空气大,NO与空气密度相差不大且与空气中的氧气反应;
(2)O2 和NO不能与水发生反应,而且难溶于水,所以能采用排水法收集,故答案为:将Ⅱ装置加满水;
(3)比较H2SO4、H2CO3和H2SiO3的酸性强弱,可在Ⅰ中用碳酸钠和稀硫酸反应生成二氧化碳,Ⅲ为硅酸钠,与二氧化碳反应可生成硅酸沉淀,
故答案为:Na2CO3;Na2SiO3溶液;装置Ⅰ中产生气泡、装置C中产生白色沉淀;
(4)比较Ca(ClO)2>Cl2>Br2氧化性强弱,在Ⅰ中Ca(ClO)2与浓盐酸反应生成氯气,氯气与Ⅲ中NaBr溶液反应生成溴,溶液颜色由无色变为橙色或橙红色,注意防止氯气污染环境,可用氢氧化钠溶液吸收氯气,
故答案为:浓盐酸;NaBr溶液;溶液由无色变为橙色或黄色或橙红色;氯气易逸出污染环境.
点评 本题考查了实验方案设计,题目难度中等,注意根据气体的性质及密度选择相应的收集方法以及实验设计的方案的设计,侧重于考查学生对实验原理的把握和对仪器的使用.


科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、Cl- | |
| B. | pH=7的溶液中:Fe3+、Mg2+、Cl-、SO42- | |
| C. | 使酚酞变红的溶液中:Ba2+、Cl-、Na+、NO3- | |
| D. | 加入铝粉产生氢气的溶液:Na+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 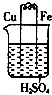 铁上有气泡 铁上有气泡 | |
| B. |  铜上有气泡 铜上有气泡 | |
| C. |  铁片上析出红色的铜 铁片上析出红色的铜 | |
| D. |  AB为导体,反应一段时间后,铁球向下倾斜 AB为导体,反应一段时间后,铁球向下倾斜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
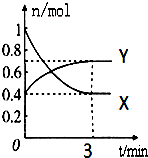 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色)?N2O4g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色)?N2O4g)(无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 原电池中,阳离子一定向负极移动 | |
| C. | 甲醇燃料电池可把化学能转化为电能 | |
| D. | 锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
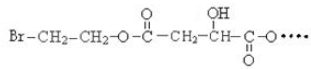
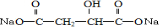 BHOCH2CH2OHC
BHOCH2CH2OHC D
D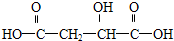
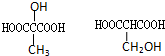
 .
.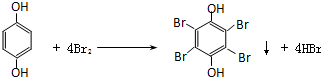 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 41.8g固体物质为Na2CO3 | |
| B. | 41.8g固体物质为0.1mol Na2CO3和0.4mol Na2O2的混合物 | |
| C. | 41.8g固体物质为31.2g NaHCO3和10.6g Na2CO3的混合物 | |
| D. | 一定量的Na2O2为78g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com