
| A. | 酸 | B. | 氧化物 | C. | 化合物 | D. | 混合物 |
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
 某兴趣小组设计简易原电池装置如图所示,该电池工作时,下列说法正确的是( )
某兴趣小组设计简易原电池装置如图所示,该电池工作时,下列说法正确的是( )| A. | 锌片做正极 | B. | 碳棒上有气泡产生 | ||
| C. | 可将电能转化为化学能 | D. | 电子由碳棒经导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
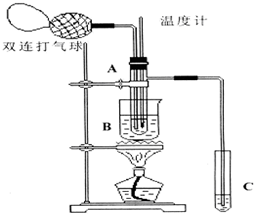 下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
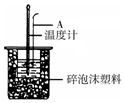 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精灯在桌上歪倒失火后,立即用湿布盖灭 | |
| B. | 灭火,也用黄沙扑灭 | |
| C. | 如果苯酚溶液沾到皮肤上,应立即用酒精洗 | |
| D. | 不慎将酸溅到眼中,应立即用干布擦去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取氧气时,用排水法收集氧气出现倒吸现象,立即打开试管上的橡皮塞 | |
| B. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| C. | 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 | |
| D. | 给试管中的液体加热时,不停沿试管倾斜方向移动试管或加入碎瓷片,以免液体暴沸伤人 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com