
从2008年6月1日起,各大超市、农贸市场不得提供免费的塑料袋。下列说法中不正确的是( )。
A.加强废旧塑料的回收与利用,能有效地治理白色污染
B.合成塑料、合成纤维、合成橡胶是三大合成材料
C.线型结构的塑料具有热塑性
D.塑料、纤维素、蛋白质、天然橡胶属于天然高分子
科目:高中化学 来源: 题型:
某有机物的结构简式如图所示。1 mol该有机物与足量的NaOH溶液共热,充分反应后最多可消耗NaOH的物质的量为( )
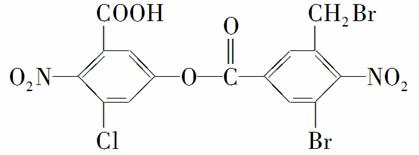
A.2 mol B.6 mol
C.8 mol D.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0.15mol /L的Na2SO4溶液的说法中,正确的是( )。
A.1L溶液中含有Na+、SO42-总数为0.3NA
B.1L溶液中含有Na+数目是0.15NA
C.1 L溶液中Na+的浓度是0.3 mol/L
D.2 L溶液中含有SO42—的浓度是0.3mol / L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列氧化反应属于吸热反应的是( )。
A.二氧化碳与赤热的炭反应生成一氧化碳 B.葡萄糖在人体内氧化分解
C.锌粒与稀H2SO4反应制取H2 D.Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应处于平衡状态时,下列说法正确的是( )。
A.反应不再进行 B.反应物浓度等于生成物浓度
C.反应物质量等于生成物质量 D.各组分浓度不再随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )。
A.在FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.Ba(OH) 2溶液与硫酸的反应:OH-+H+ = H2O
C.在Al(OH) 3中滴加盐酸:Al(OH) 3+3H+ = Al3++3H2O
D.铁与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是______________和________________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
|
T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30 ℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40 ℃、pH=3.0
b.10 ℃、pH=4.0
c.30 ℃、pH=7.0
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是新型能源和重要化工原料。
 已知:①2CO(g)+O2(g)=2CO2(g)
已知:①2CO(g)+O2(g)=2CO2(g) 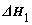 ; ②CH4(g)+2O2(g)=CO2(g)+2H2O(l)
; ②CH4(g)+2O2(g)=CO2(g)+2H2O(l) 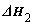
③H2(g)+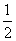 O2(g)=2H2O(l)
O2(g)=2H2O(l) 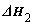
(1)科学家提出一种利用天然气制备氢气的方法:CH4(g)+CO2(g)=2CO(g)+2H2(g) 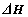
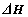 = 。这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是 。
= 。这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是 。
(2)氨气是重要化工原料,在国民经济中占重要地位。
①在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:
N2(g)+3H2(g) 2NH3(g)
2NH3(g) 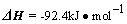
实验测得起始、平衡时的有关数据如下表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| I | 3 n | n | 0 | 放出热量a kJ |
| II | 3 n | 2 n | 0 | 放出热量b kJ |
| III | 6 n | 2 n | 0 | 放出热量c kJ |
下列判断正确的是 。
A.N2的转化率:II>I>III B.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:III>I D.平衡常数:III>II>I
②在密闭恒容容器中投入一定量氮气和氢气,混合气体中氨气体积分数和温度关系如图所示:
曲线TJ段变化主要原因是 ,JL段变化的主要原因是 。氨气正反应速率:T点 L点(填:大于、小于或等于)。
③在2 L密闭容器中充入一定量的氨气,氨气的物质的量与反应时间关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | ••• |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
在该条件下,前5分钟H2平均反应速率为 。
④常温下,在V mL的a mol·L-1稀硫酸溶液中滴加b mol·L-1稀氨水V mL恰好使混合溶液呈中性。此时,一水合氨的电离常数Kb= (用含a、b代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com