
【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇: 反应I:CO(g)+2H2(g)CH3OH(g)△H1
反应II:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H10 (填“>”、“=”或“<”).
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CH3OH)=0.8mol/L,则CO的转化率为 , 此时的温度为(从上表中选择).
④恒温、恒容时,下列情况不能说明反应I已经达到化学平衡状态的是 .
a、容器各物质的浓度保持不变; b、容器内压强保持不变;
c、υ(CO)消耗═1/2υ(H2)生成 d、容器内的密度保持不变
(2)25℃、101kPa时,燃烧16g液体甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式: .
(3)某实验小组依据甲醇燃烧的反应原理,设计一个燃料电池电解Na2SO4溶液(图如下).请根据图示回答下列问题: ①通入甲醇蒸气的电极应为极(填写“正”或“负”),该电极上发生的电极反应是(填字母代号).
a.2CH3OH﹣12e﹣+3O2═2CO2+4H2O
b.CH3 OH﹣6e﹣+8OH﹣═CO32﹣+6H2O
c.O2+2H2O+4e﹣═4OH﹣
d.O2﹣4e﹣+4H+═2H2O
②写出电极A的名称 . 写出B电极的电极反应式 .
③当碱性甲醇燃料电池消耗3.36L 氧气时(折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是 . 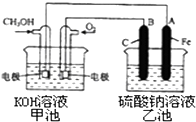
【答案】
(1)Ⅰ;<;80%;250℃; d
(2)CH3OH(l)+ ![]() O2(g )═CO2(g )+2H2O(l)△H1=﹣726.52 kJ/mol
O2(g )═CO2(g )+2H2O(l)△H1=﹣726.52 kJ/mol
(3)负; b;阴极;4OH﹣﹣4e﹣═O2↑+2H2O;0.45mol
【解析】解:(1)①“原子经济”是指在化学品合成过程中,所用的所有原材料尽可能多的转化到最终产物中,分析反应可知,反应Ⅰ中原子利用率为100%,符合“原子经济”,所以答案是:Ⅰ;
②由表数据可知,温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正向放热反应,即△H1<0,所以答案是:<;
③按反应Ⅰ充分反应达到平衡后,测得c(CH3OH)=0.8mol/L,其物质的量为1.6mol,则:
CO (g)+ | 2H2 (g) | CH3OH (g) | |
起始(mol) | 2 | 6 | 0 |
转化(mol) | 1.6 | 3.2 | 1.6 |
平衡(mol) | 0.4 | 2.8 | 1.6 |
CO的转化率= ![]() ×100%=80%,
×100%=80%,
此时的平衡常数K= ![]() =
=  ≈2.041,所以温度为250℃,
≈2.041,所以温度为250℃,
所以答案是:80%;250℃;
④a.容器各物质的浓度保持不变,说明反应到达平衡,故a正确;
b.随反应进行,容器内气体物质的量进行,容器内压强减小,容器内压强保持不变,说明反应到达平衡,故b正确;
c.由方程式可知υ(CO)生成═ ![]() υ(H2)生成,而υ(CO)消耗═
υ(H2)生成,而υ(CO)消耗═ ![]() υ(H2)生成,说明υ(CO)生成═υ(CO)消耗,反应到达平衡状态,故c正确;
υ(H2)生成,说明υ(CO)生成═υ(CO)消耗,反应到达平衡状态,故c正确;
d.混合气体总质量不变,容器容积始终不变,容器内的密度始终保持不变,故d错误,
故选:d;(2)1mol甲醇燃烧放出的热量为363.26kJ× ![]() =726.52 kJ,热化学方程式为:CH3OH(l)+
=726.52 kJ,热化学方程式为:CH3OH(l)+ ![]() O2(g )═CO2(g )+2H2O(l)△H1=﹣726.52 kJ/mol,
O2(g )═CO2(g )+2H2O(l)△H1=﹣726.52 kJ/mol,
所以答案是:CH3OH(l)+ ![]() O2(g )═CO2(g )+2H2O(l)△H1=﹣726.52 kJ/mol;(3)①原电池负极发生氧化反应,反应中甲醇发生氧化反应,甲醇蒸气的电极应为负极,甲醇失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3 OH﹣6e﹣+8OH﹣═CO32﹣+6H2O,
O2(g )═CO2(g )+2H2O(l)△H1=﹣726.52 kJ/mol;(3)①原电池负极发生氧化反应,反应中甲醇发生氧化反应,甲醇蒸气的电极应为负极,甲醇失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3 OH﹣6e﹣+8OH﹣═CO32﹣+6H2O,
所以答案是:负;b;
②电解池中A连接电源负极,则A为阴极,B连接电源正极,B为阳极,阳极上发生氧化反应,氢氧根离子放电生成氧气与水,阳极电极反应式为:;4 OH﹣﹣4 e﹣═O2↑+2H2O,
所以答案是:阴极;4 OH﹣﹣4 e﹣═O2↑+2H2O;
③标况下,3.36L 氧气物质的量为 ![]() =0.15mol,电解池总反应为2H2O
=0.15mol,电解池总反应为2H2O ![]() 2H2↑+O2↑,根据电子转移守恒,生成氢气、氧气物质的量为3×0.15mol=0.45mol,
2H2↑+O2↑,根据电子转移守恒,生成氢气、氧气物质的量为3×0.15mol=0.45mol,
所以答案是:0.45mol.
【考点精析】掌握化学平衡状态本质及特征和化学平衡的计算是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】室温下,水的电离达到平衡:H2O![]() H+ + OH-。下列叙述正确的是
H+ + OH-。下列叙述正确的是
A. 将水加热,平衡向正反应方向移动,Kw不变
B. 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C. 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D. 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)= c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2SO3·CuSO3·2H2O是一种深红色固体(以下用M表示)。某学习小组拟测定胆矾样品的纯度,并以其为原料制备M。
已知:①M不溶于水和乙醇,100℃时发生分解反应;
②M可由胆矾和SO2为原料制备,反应原理为3Cu2++6H2O+3SO2![]() Cu2SO3·CuSO3·2H2O↓+8H++SO42-。
Cu2SO3·CuSO3·2H2O↓+8H++SO42-。
I.测定胆矾样品的纯度。
(1)取w g胆矾样品溶于蒸馏水配制成250mL溶液,从中取25.00mL于锥形瓶中,加入指示剂,用c mol·L-1EDTA(简写成Na4Y)标准溶液滴定至终点(滴定原理:Cu2++Y4-====CuY2-),测得消耗了V mL EDTA标准溶液。则该胆矾样品的纯度为____________%(用含c、V、w的代数式表示)。如果滴定管装液前没有用EDTA标准溶液润洗,测得的结果会_________ (填“偏高”“偏低”或“无影响”)。
Ⅱ.制备M。实验装置如下图所示:
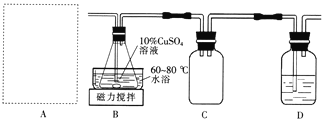
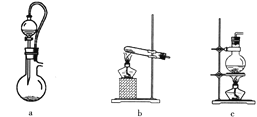
(2)实验室用70%硫酸与亚硫酸钠粉末在常温下制备SO2。上图A处的气体发生装置可从下图装置中选择,最合适的是________(填字母)。
(3)装置D中的试剂是____________。装置B中水浴加热的优点是____________________。
(4)实验完毕冷却至室温后,从锥形瓶中分离产品的操作包括:__________、水洗、乙醇洗、常温干燥,得产品Cu2SO3·CuSO3·2H2O。检验产品已水洗完全的操作是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.不需要加热就能发生的反应是放热反应
B.构成原电池正极和负极的材料必须是两种金属
C.化学能是能量的一种形式,它不仅可以转化为热能,也能转化为电能
D.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关生物体细胞组成元素的叙述,错误的是( )
A. 在不同生物的体细胞内,组成它们的化学元素种类大体相同
B. 组成细胞的最基本元素是C
C. 在同一生物的不同体细胞内,各种化学元素的含量相同
D. 组成生物体细胞的化学元素,在无机自然界中都能找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
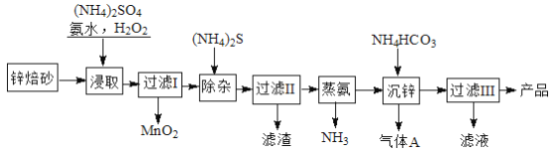
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42-)时,溶液呈___________ (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是__________________(任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为____________________________。
(4)“沉锌”的离子方程式为__________________________________。
(5)“过滤III”所得滤液可循环使用,其主要成分的化学式是__________________。
(6)己知:HCN的电离常数Ka=4.9×10 -10, H2S 的电离常数Ka1=1.3×10 -7,Ka2=7.0×10 -15,向NaCN 溶液中通入少量的H2S 气体,反应的离子方程式为______________________________________。在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.0×10 -4molL-1时,Mn2+开始沉淀,则a=____________。[已知: Ksp(MnS)=1.4×10 -15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和 铜片中无杂质,气体体积已转换为标准状况。下列说法正确的是 ( )

A. a 电极的电极材料是铜
B. 如果将稀硫酸换为 CuSO4 溶液,则不能达到实验目的
C. 锌与稀硫酸反应时放出的热量对实验测定不产生影响
D. 若量筒中收集到 a L H2,则电解质溶液中通过了![]() mol 电子
mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是
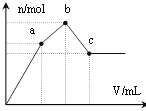
A. a点的溶液呈中性
B. 从开始到b点发生反应的总的离子方程式是:Al3++2SO42-+2Ba2++3OH-= Al(OH)3↓+2BaSO4↓
C. c点加入Ba(OH)2溶液的体积为200 mL
D. c点溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图示装置进行下列实验,能达到实验目的的是
溶液a | 固体b | 溶液c | 实验目的:验证 |
| |
A | 浓硝酸 | NaHCO3 | Na2SiO3 | 非金属性:N>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓盐酸 | CaCO3 | NaAlO2 | 酸性:HCl>H2CO3>Al(OH)3 | |
D | 浓氨水 | CaO | 酚酞溶液 | NH3·H2O是弱碱 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com