
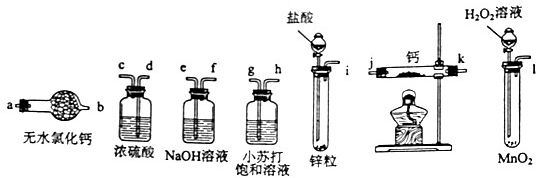
按下列实验方法制备气体,合理又实用的是( )
A.锌粒与稀硝酸反应制备氢气
B.向饱和氯化钠溶液中滴加浓硫酸制备HCl
C.亚硫酸钠与浓硫酸反应制备SO2
D.大理石与浓硫酸反应制备CO2
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
A.生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式_________________________。
(2)根据等电子原理,写出CO分子的结构式______________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是_____________________;甲醛分子中碳原子轨道的杂化类型为_____________________。
②甲醛分子的空间构型是_____________________;1 mol甲醛分子中σ键的数目为_____________________。
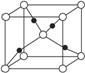
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为_____________________。
B.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
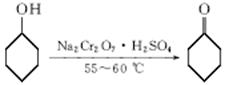
环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3, | 溶解性 |
环己醇 | 161.1(97.8)* | 0.962 4 | 能溶于水 |
环己酮 | 155.6(95)* | 0.947 8 | 微溶于水 |
水 | 100.0 | 0.998 2 |
|
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~
①酸性Na2Cr2O7溶液的加料方式为_____________________。
②蒸馏不能分离环己酮和水的原因是_____________________。
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~
①上述操作的正确顺序是_______________________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需_______________。
③在上述操作c中,加入NaCl固体的作用是_______________________________________
______________________________________________________________________________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有______________种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省潍坊高密市高三4月月考理综化学试卷(解析版) 题型:填空题
氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为???????????????????????????????????? 。
(2)下列实验能比较镁和铝的金属性强弱的是???? ??? ?? (填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s)??? ΔH1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s)???? ΔH2 = -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是?????????????????????? ????? 。
(4)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为??????????????????? ????????? ???????????? 。
(5)工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g) + 2N2(g) + 6H2(g)  Si3N4(s) + 12HCl(g)?? △H<0??
Si3N4(s) + 12HCl(g)?? △H<0??
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是???????? mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应????? (填“增大”、“减小”或“不变”)。
(6)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=?????????????? 。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为????? 以上。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com