
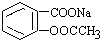 转变为
转变为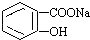 的方法是( )
的方法是( )| A. | 与足量Na0H溶液共热后,再通入CO2 | |
| B. | 溶液加热,通入足量的SO2 | |
| C. | 与稀硫酸共热后,加入足量Na0H溶液 | |
| D. | 足量稀硫酸共热后,加入足量NaHCO3 |
分析 因羧酸、酚羟基均与碱反应生成盐,则将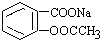 转变为
转变为 ,可选择与碱反应,然后利用碳酸酸性大于苯酚酸性,再通入二氧化碳即可;或先加稀硫酸水解后,利用苯酚酸性大于碳酸氢根离子的酸性,再与NaHCO3反应即可,以此来解答.
,可选择与碱反应,然后利用碳酸酸性大于苯酚酸性,再通入二氧化碳即可;或先加稀硫酸水解后,利用苯酚酸性大于碳酸氢根离子的酸性,再与NaHCO3反应即可,以此来解答.
解答 解:A.
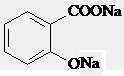 ,再通入二氧化碳气体可生成
,再通入二氧化碳气体可生成
B.亚硫酸酸性比苯甲酸强,则通入足量的SO2,不能得到羧酸钠结构,故B错误;
C.与稀硫酸共热后,加入足量的NaOH溶液,苯酚结构能与NaOH反应,则不能得到产物,故C错误;
D.与稀H2SO4共热后,酯基水解生成苯酚结构,加入足量的NaHCO3,羧基与NaHCO3反应得到产物,故D正确.
故选AD.
点评 本题考查有机物的结构和性质,根据物质的官能团变化、物质的性质选择合适的合成途径是解答本题的关键,注意碳酸酸性>苯酚酸性>碳酸氢根离子的酸性,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{20×1{0}^{-3}}{127}$mol | B. | 20M mol | C. | $\frac{20×1{0}^{-3}}{M}$mol | D. | $\frac{20}{M}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3.
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3. 是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠(
是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯.已知:
)]、甲醇为原料制备苯甲酸甲酯.已知:| 熔点℃ | 沸点℃ | 水溶性 | |
| 甲醇 | -97.8 | 64.7 | 易溶 |
| 苯甲酸 (一元弱酸) | 122.4 | 249.3 | 常温:0.17g 100℃:6.8g |
| 苯甲酸甲酯 | -12.3 | 198 | 难溶 |


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com