
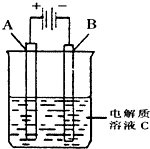
 �£�N2H4���ֳ���������һ�ֿ�ȼ��Һ�壬��ȼ���Ƚϴ���ȼ�ղ���Ի�������Ⱦ���ʿ����������ȼ�ϣ�
�£�N2H4���ֳ���������һ�ֿ�ȼ��Һ�壬��ȼ���Ƚϴ���ȼ�ղ���Ի�������Ⱦ���ʿ����������ȼ�ϣ�| 1 |
| 2 |
| ||
| 10.8g |
| 108g/mol |
| 0.1mol |
| 4 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
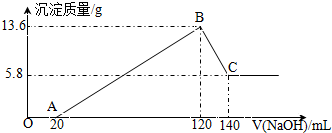 ��һ��������Mg-Al�Ͻ�Ͷ��100mLһ�����ʵ���Ũ�ȵ�ijHCl��Һ�У���ַ�Ӧ����Ӧ�����Һ����μ���һ�����ʵ���Ũ�ȵ�NaOH��Һ�����ɳ���������������NaOH��Һ�������ϵ��ͼ���ش��������⣺
��һ��������Mg-Al�Ͻ�Ͷ��100mLһ�����ʵ���Ũ�ȵ�ijHCl��Һ�У���ַ�Ӧ����Ӧ�����Һ����μ���һ�����ʵ���Ũ�ȵ�NaOH��Һ�����ɳ���������������NaOH��Һ�������ϵ��ͼ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
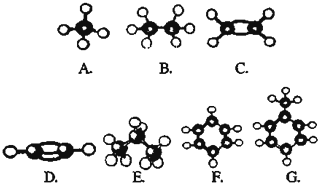
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
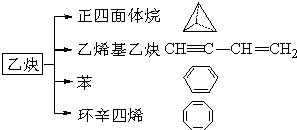 ��Ȳ��һ����Ҫ���л�����ԭ�ϣ�����ȲΪԭ���ڲ�ͬ�ķ�Ӧ�����¿���ת�������»����������и��⣺
��Ȳ��һ����Ҫ���л�����ԭ�ϣ�����ȲΪԭ���ڲ�ͬ�ķ�Ӧ�����¿���ת�������»����������и��⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ����� |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800�� | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800�� | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800�� | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 800�� | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����20.0gNaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ�����������ʾ�÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽΪNaOH��aq��+HCl��aq��= NaCl��aq��+H2O��1����H=+57.3kJ/mol | ||
| B����֪C��ʯī��s��=C�����ʯ��s����H��0������ʯ��ʯī�ȶ� | ||
| C����֪2H2��g��+O2��g��=2H2O��g����H=-483.6kJ/mol����������ȼ����Ϊ241.8kJ | ||
D����֪C��s��+O2��g��=CO2��g����H1��C��s��+
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ħ���ǹ��ʿ�ѧ�罨����õ�һ�������� |
| B��Ħ�������ʵ����ĵ�λ�����Ħ������Ϊmol |
| C��Ħ���������ʵĺ�������������ӵ�������ϵ���� |
| D�������Ϲ涨��0.012 kg12C�����е�̼ԭ�ӵ����ʵ���Ϊ1 mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com